La abstinencia de opioides constituye un proceso fisiológico y neuroquímico complejo que puede resultar profundamente angustiante a nivel físico y psicológico. A pesar de que rara vez implica un riesgo directo para la vida en individuos sanos, su severidad y duración varían de manera significativa en función del tipo de opioide involucrado, la dosis consumida, la duración del uso, la vía de administración y el estado general de salud del individuo. La experiencia subjetiva de la abstinencia puede ser descrita como agónica, no por su letalidad intrínseca, sino por la intensidad de los síntomas que emergen cuando el organismo, previamente adaptado a la presencia constante del opioide, se ve súbitamente privado de su efecto.
Desde una perspectiva fisiológica, los opioides actúan principalmente sobre los receptores mu, delta y kappa del sistema nervioso central, modulando funciones esenciales como la percepción del dolor, el estado de ánimo, la respiración y el control gastrointestinal. El uso prolongado conduce a una regulación a la baja de estos receptores y a alteraciones en múltiples sistemas neuroendocrinos, particularmente en el eje hipotálamo-hipófiso-adrenal. Cuando cesa la administración del opioide, el sistema nervioso, ahora desprovisto de la sustancia que antes mantenía en equilibrio relativo la homeostasis, responde con una hiperactividad del sistema nervioso simpático. Esta respuesta se manifiesta con síntomas como ansiedad intensa, insomnio, midriasis, diaforesis profusa, taquicardia, piloerección, dolores musculares, náuseas, vómitos y diarrea.
Aunque estos síntomas no suelen resultar fatales por sí mismos, las pérdidas importantes de líquidos y electrolitos derivadas de los vómitos y las deposiciones frecuentes pueden ocasionar complicaciones graves si no se tratan adecuadamente. En casos donde no se corrigen estos desequilibrios hidroelectrolíticos —particularmente los niveles de sodio, potasio y bicarbonato— pueden desarrollarse arritmias, hipotensión severa, convulsiones o incluso estado de choque, complicaciones que sí podrían poner en riesgo la vida.
La temporalidad de la abstinencia varía ampliamente dependiendo de la farmacocinética del opioide implicado. Las sustancias con vidas medias más largas, como la metadona o la oxicodona de liberación prolongada, generan una aparición más tardía de los síntomas, usualmente entre veinticuatro y cuarenta y ocho horas tras la última dosis. No obstante, esta fase aguda puede extenderse durante más de una semana, debido a la liberación gradual del fármaco desde los tejidos corporales. En contraste, opioides de acción corta, como la morfina o la heroína, inducen un inicio más rápido de la abstinencia, aunque con una duración generalmente menor.
Una situación particularmente compleja se presenta con el consumo de fentanilo no farmacéutico. A diferencia del fentanilo médico, cuya farmacocinética es bien conocida, las formulaciones ilícitas suelen contener mezclas impredecibles de análogos de fentanilo con diferentes potencias y tiempos de eliminación. Esta variabilidad impide predecir con precisión el inicio y la evolución del síndrome de abstinencia. En algunos casos, los síntomas pueden comenzar en cuestión de horas, mientras que en otros pueden demorarse varios días, y su duración puede prolongarse indefinidamente, dependiendo de la naturaleza específica de los compuestos involucrados.
Manifestaciones clínicas
La abstinencia de opioides representa un proceso fisiopatológico profundamente perturbador, que surge como consecuencia directa de la interrupción abrupta o la reducción significativa del consumo habitual de estas sustancias en individuos que han desarrollado dependencia. Esta condición implica una desregulación abrupta de los sistemas neuroquímicos que se han adaptado, a lo largo del tiempo, a la presencia constante de opioides exógenos. Dado que estos fármacos interfieren con funciones neurofisiológicas esenciales —incluyendo la modulación del dolor, la respuesta al estrés, el control autonómico y la homeostasis digestiva— su retirada repentina provoca una cascada de respuestas adaptativas adversas en múltiples sistemas del organismo.
Los síntomas clásicos que acompañan la abstinencia de opioides incluyen náuseas, vómitos, diarrea, escalofríos, sudoración profusa, temblores, mialgias, dolor óseo y un estado persistente de ansiedad y agitación. Esta constelación sintomática se manifiesta como una activación masiva del sistema nervioso simpático y de diversas rutas neuroendocrinas que, ante la ausencia del opioide, se tornan hiperactivas. En muchos aspectos, el cuadro clínico se asemeja al de una infección viral o bacteriana sistémica grave, como puede ser el caso de la influenza o algunas formas de gastroenteritis aguda. La similitud se debe a la convergencia de síntomas comunes como fiebre subjetiva, malestar generalizado, escalofríos, sudoración excesiva, deshidratación, pérdida de apetito y deterioro del estado anímico.
Desde una perspectiva psicológica, la abstinencia se acompaña de una disforia intensa, caracterizada por una profunda sensación de malestar emocional, irritabilidad, insomnio y una necesidad imperiosa de aliviar los síntomas mediante el consumo de opioides. Este fenómeno, central en los trastornos por uso de sustancias, es uno de los principales motores que perpetúan el ciclo adictivo. La búsqueda de alivio inmediato frente al sufrimiento físico y mental inducido por la abstinencia suele dominar la conducta del individuo, disminuyendo su capacidad para tomar decisiones racionales e impulsándolo a retomar el consumo, incluso a sabiendas de las consecuencias adversas.
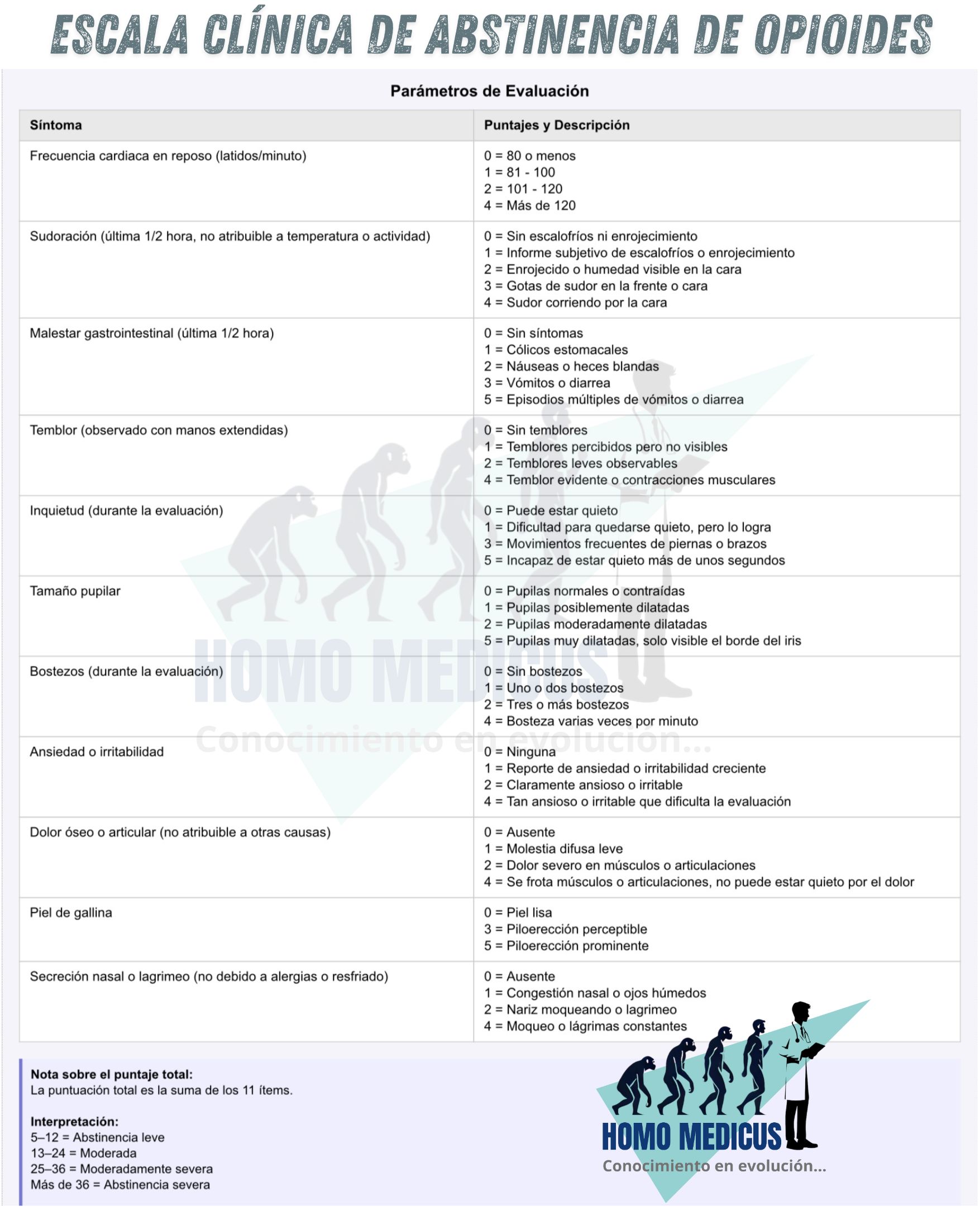
Con el fin de evaluar y monitorear de manera sistemática la intensidad del síndrome de abstinencia, en la práctica clínica se emplea la Escala Clínica de Abstinencia de Opioides, (COWS). Esta herramienta integra tanto signos objetivos —como la frecuencia cardíaca, la presión arterial, la diaforesis, el bostezo y la agitación psicomotora— como síntomas subjetivos reportados por el paciente, tales como la ansiedad, la sensación de “piel de gallina”, el dolor muscular y el malestar gastrointestinal. La escala produce una puntuación acumulativa que permite clasificar la severidad del cuadro: una puntuación entre trece y veinticuatro puntos indica una abstinencia de intensidad moderada.
Además de su utilidad diagnóstica, la escala COWS cumple un papel esencial en la toma de decisiones terapéuticas. Es particularmente relevante para establecer el momento óptimo para iniciar el tratamiento con buprenorfina, un agonista parcial de los receptores opioides que, si se administra prematuramente, puede precipitar un síndrome de abstinencia agudo más severo. Por tanto, una evaluación adecuada mediante esta escala asegura no solo un seguimiento clínico preciso, sino también una intervención farmacológica segura y eficaz.
Exámenes diagnósticos
Las pruebas toxicológicas constituyen una herramienta auxiliar de gran valor clínico en la evaluación y el manejo del trastorno por uso de opioides, ya que permiten detectar y, en algunos casos, cuantificar la presencia de sustancias psicoactivas o sus metabolitos en diversas matrices biológicas. Estas pruebas no solo ofrecen una forma objetiva de verificar el consumo de sustancias, complementando el relato del paciente, sino que también permiten confirmar la adherencia al tratamiento con medicamentos prescritos, identificar posibles exposiciones no reveladas y ajustar intervenciones terapéuticas con base en información concreta.
En los trastornos por uso de sustancias, la historia clínica basada únicamente en el autoinforme del paciente puede ser limitada, ya sea por omisión involuntaria, negación deliberada, falta de conocimiento sobre la composición de las sustancias consumidas, o incluso por confusión en relación con las múltiples sustancias involucradas. En este sentido, las pruebas toxicológicas ofrecen una ventana bioquímica objetiva al patrón de consumo reciente, contribuyendo a una evaluación diagnóstica más precisa y a la toma de decisiones clínicas fundamentadas. Sin embargo, su uso debe estar claramente justificado dentro del marco terapéutico, ya que su aplicación indiscriminada o con fines sancionadores —por ejemplo, para expulsar a un paciente de un programa de tratamiento— puede producir más daño que beneficio, al erosionar la confianza entre paciente y clínico, aumentar la estigmatización y comprometer la continuidad del tratamiento.
Estas pruebas pueden realizarse sobre múltiples tipos de muestras biológicas, como orina, fluido oral, cabello, sudor e incluso meconio en recién nacidos expuestos intraútero a opioides. No obstante, la orina sigue siendo la matriz más utilizada por su accesibilidad, facilidad de recolección, carácter no invasivo, y la disponibilidad de múltiples tecnologías para su análisis.
Existen dos metodologías principales para la detección de sustancias en orina:
1. Inmunoensayos, incluyendo el ensayo por inmunoabsorción ligado a enzimas (ELISA)
Estos ensayos están basados en la especificidad de los anticuerpos para reconocer compuestos estructuralmente relacionados. Permiten una detección rápida y cualitativa —es decir, confirman únicamente la presencia o ausencia de una clase de drogas— y suelen utilizarse como primera línea de cribado. El panel estándar de inmunoensayo para opioides en orina se enfoca en compuestos naturales derivados del opio, como la morfina, la codeína y la heroína, así como algunos metabolitos relacionados. No obstante, este tipo de prueba tiene una sensibilidad limitada para opioides semisintéticos o completamente sintéticos, tales como el fentanilo, la buprenorfina, la metadona o la oxicodona. Para detectar estos compuestos, es necesario solicitar ensayos específicos por separado, dirigidos contra las moléculas de interés.
2. Cromatografía líquida o gaseosa acoplada a espectrometría de masas (LC-MS o GC-MS)
Esta técnica de alta precisión se utiliza principalmente como prueba confirmatoria. A diferencia de los inmunoensayos, permite identificar de forma inequívoca compuestos individuales y cuantificarlos con exactitud, lo que resulta particularmente útil ante resultados inesperados, en situaciones de litigio, o para evaluar adherencia a tratamientos farmacológicos. Asimismo, permite la detección de falsos positivos o negativos derivados de interferencias químicas o metabolitos estructuralmente similares.
La mayoría de los opioides pueden identificarse en orina durante un periodo de uno a tres días tras el último consumo. Sin embargo, existen variaciones significativas dependiendo del compuesto. Por ejemplo, la heroína se metaboliza rápidamente a morfina, reduciendo su ventana de detección a menos de veinticuatro horas. En cambio, sustancias como la metadona pueden ser detectadas durante aproximadamente una semana, y la buprenorfina entre uno y once días. Algunos opioides sintéticos altamente lipofílicos, como ciertos análogos de fentanilo no farmacéutico, pueden permanecer detectables durante hasta tres semanas, en parte debido a su acumulación en los tejidos grasos y su lenta eliminación.
El rigor en la interpretación de los resultados es esencial, ya que pueden presentarse falsos positivos por la presencia de compuestos estructuralmente similares, como el dextrometorfano, la difenhidramina, algunas quinolonas, semillas de amapola o ciertos fármacos como la rifampicina o el verapamilo. Asimismo, falsos negativos pueden surgir cuando los niveles de la sustancia están por debajo del umbral de detección establecido por la prueba.
La validez de una muestra también puede comprometerse por intentos de adulteración o dilución. Por ello, se utilizan múltiples parámetros fisicoquímicos para verificar la integridad de la muestra:
- La temperatura de la orina debe estar entre 32 y 38 grados Celsius dentro de los primeros cuatro minutos posteriores a la recolección.
- La concentración de creatinina, un marcador de dilución, debe ser mayor de veinte miligramos por decilitro (valores inferiores a cinco miligramos por decilitro sugieren una muestra diluida artificialmente).
- El pH debe mantenerse dentro del rango fisiológico de 3 a 11, y la gravedad específica entre 1.002 y 1.020.
- La presencia de oxidantes o agentes blanqueadores también puede indicar manipulación, y valores fuera de los rangos normales requieren la repetición de la prueba bajo condiciones más controladas.
Tratamiento
El tratamiento adecuado de la abstinencia de opioides representa un componente esencial en la atención médica integral de las personas con trastorno por uso de opioides. La interrupción abrupta del consumo en individuos con dependencia produce un síndrome de abstinencia caracterizado por manifestaciones físicas y psíquicas intensamente desagradables. Si estas no se tratan de manera eficaz, pueden generar un profundo malestar, desestabilización clínica y un marcado deterioro del vínculo terapéutico, lo cual con frecuencia conduce a que los pacientes abandonen la atención médica antes de tiempo o busquen alivio mediante el uso de sustancias no prescritas, incluso durante su estancia hospitalaria. Estas situaciones no solo comprometen el tratamiento actual, sino que aumentan el riesgo de recaída, complicaciones clínicas y desenlaces adversos.
El abordaje terapéutico más efectivo para la abstinencia de opioides es el inicio del tratamiento con medicamentos para el trastorno por uso de opioides, entre los cuales destacan la metadona y la buprenorfina. Estos fármacos han demostrado reducir eficazmente los síntomas de abstinencia, estabilizar al paciente y facilitar la transición hacia un tratamiento a largo plazo, promoviendo la retención en los programas de atención y reduciendo la mortalidad relacionada con opioides. A pesar de que existen múltiples estrategias para manejar la abstinencia, el tratamiento con agonistas opioides sigue siendo la primera línea por su eficacia superior.
El manejo clínico puede incorporar tanto intervenciones farmacológicas con opioides como sin ellos, dependiendo del contexto, la disponibilidad de recursos y la disposición del paciente. En entornos de atención aguda, como los servicios de urgencias o las unidades de hospitalización, puede utilizarse cualquier opioide de manera controlada para mitigar los síntomas de abstinencia. En estos casos, la metadona o la buprenorfina deberían ser ofrecidas de manera prioritaria como tratamiento estructurado, dado que no solo alivian los síntomas agudos, sino que también permiten iniciar el tratamiento a largo plazo del trastorno por uso de opioides.
Cuando un paciente rechaza iniciar tratamiento con medicamentos como la buprenorfina o la metadona, se pueden emplear estrategias intermedias, como la administración de opioides de acción corta o el uso de metadona en dosis bajas (usualmente entre treinta y cincuenta miligramos por vía oral al día), exclusivamente durante la hospitalización. Esta aproximación tiene como objetivo proporcionar alivio sintomático mientras se intenta construir confianza terapéutica, educar al paciente y, eventualmente, promover la transición hacia un tratamiento de mantenimiento.
La transición eficaz a una dosis terapéutica de medicamentos como la metadona o la buprenorfina puede requerir varios días o incluso semanas, dependiendo del nivel de tolerancia del paciente, el patrón de consumo previo y la farmacocinética del opioide utilizado. En pacientes que han consumido opioides de acción prolongada, como metadona o fentanilo no farmacéutico —este último caracterizado por su alta potencia, acumulación en tejidos y vida media variable— es recomendable el uso de opioides de acción corta como puente terapéutico. Estos pueden ser administrados durante el período en que el opioide de acción prolongada aún está presente en el organismo, lo que permite mitigar el riesgo de precipitación de la abstinencia si se introduce la buprenorfina de forma prematura. Alternativamente, también pueden utilizarse durante los primeros días del régimen de buprenorfina en casos de microdosificación o inducción progresiva, cuando las dosis iniciales aún no alcanzan niveles terapéuticos efectivos.
Del mismo modo, la metadona, cuya titulación segura hasta una dosis efectiva puede requerir varios días o semanas, los opioides de acción corta pueden usarse como medida temporal para cubrir el déficit analgésico y evitar la aparición de síntomas de abstinencia durante la fase de estabilización.

Fuente y lecturas recomendadas:
-
Eaton EF et al. In-hospital illicit drug use and patient-directed discharge: barriers to care for patients with injection-related infections. Open Forum Infect Dis. 2020;7:74. [PMID: 32258203]
- https://nida.nih.gov/sites/default/files/ClinicalOpiateWithdrawalScale.pdf




