Las proteínas son macromoléculas formadas por la polimerización de aminoácidos. Existen 20 Ⲁ-L-aminoácidos diferentes que forman las proteínas, unidos por enlaces peptídicos.
Los aminoácidos y las proteínas son excelentes amortiguadores en condiciones fisiológicas. Los amortiguadores son soluciones que minimizan un cambio en el pH al añadir un ácido o una base. Las proteínas son una parte importante de la capacidad de tamponamiento de las células y de los líquidos biológicos, incluida la sangre.
Estructura
La estructura primaria de las proteínas es la secuencia lineal de sus aminoácidos.
En las proteínas, el grupo carboxilo de un aminoácido se une al grupo amino del aminoácido siguiente, formando un enlace amida (péptido).
Las unidades de aminoácidos de una cadena peptídica se denominan residuos aminoácidos. Una cadena peptídica formada por dos o tres residuos aminoácidos se denomina dipéptido o tripéptido respectivamente.
El residuo aminoácido que tiene un grupo amino libre en uno de los extremos del péptido se denomina aminoácido N-terminal (amino terminal), mientras que el residuo que tiene un grupo carboxilo libre en el otro extremo se denomina aminoácido C-terminal (carboxilo terminal). Las proteínas contienen entre 50 y 2,000 residuos aminoácidos.
La masa molecular de la mayoría de las proteínas oscila entre 5,500 y 220,000 Da.
Las cadenas laterales de los aminoácidos contribuyen tanto a la carga como a la hidrofobicidad de las proteínas. Las proteínas ricas en grupos amino alifáticos o aromáticos son relativamente insolubles en agua y se encuentran frecuentemente en las membranas celulares. Las proteínas ricas en aminoácidos polares son más hidrosolubles.
La carga de la proteína depende principalmente de los grupos funcionales de la cadena lateral de los aminoácidos, junto con una contribución menos importante de los grupos amino y carboxilo de los aminoácidos terminales.
El balance entre cadenas laterales ácidas y básicas en una proteína determina su punto isoeléctrico y la carga neta en disolución.
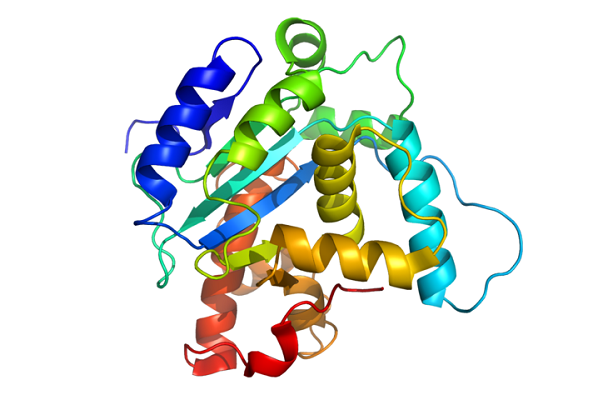
La estructura secundaria de las proteínas está determinada por las interacciones entre los grupos carbonilo y amida del esqueleto. En la estructura secundaria de las proteínas las interacciones mediante puentes de hidrógeno entre el oxígeno del grupo carbonilo de una cadena peptídica y el hidrógeno de amida de otro puente peptídico cercano determinan la estructura.
Existen dos tipos de estructura secundaria:
-
- la hélice Ⲁ.
- la hoja plegada ß.
- La hélice Ⲁ es una estructura en forma de varilla con la cadena peptídica fuertemente enrollada y con las cadenas laterales de los residuos aminoácidos extendiéndose hacia fuera del eje de la espiral.
- La hoja plegada ß es una estructura extendida. Si los enlaces de hidrógeno se forman lateralmente entre enlaces peptídicos, las secuencias polipeptídicas se ordenan de forma paralela o antiparalela entre sí.
Se denomina estructura terciaria de una proteína a su conformación tridimensional, plegada y biológicamente activa. La estructura terciaria refleja la forma global de la molécula y por lo general consta de varias unidades pequeñas de menor tamaño también plegadas denominadas dominios.
La estructura terciaria tridimensional de una proteína está estabilizada por interacciones entre grupos funcionales de las cadenas laterales:
-
- puentes disulfuro covalentes
- enlaces de hidrógeno
- puentes salinos
- interacciones hidrofóbicas
La estructura cuaternaria de proteínas con múltiples subunidades está determinada por interacciones covalentes y no covalentes entre las superficies de las subunidades. La mayoría de las proteínas mayores de 50 kDa constan de más de una cadena y se conocen como proteínas diméricas, triméricas o multiméricas. La unidad más pequeña se denomina monómero o subunidad.