Características de los aminoácidos que forman proteínas
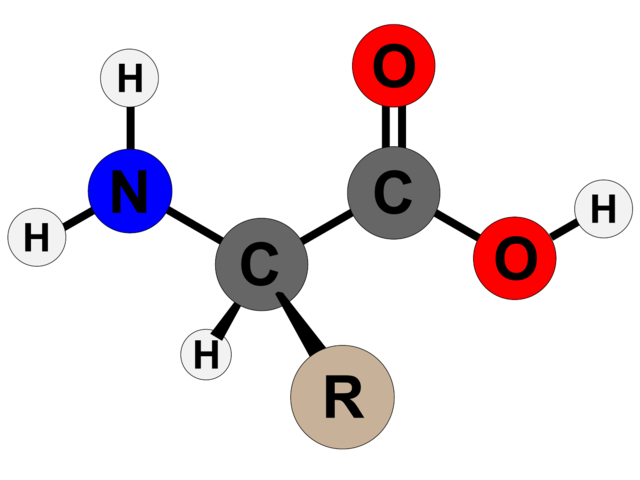
La estructura básica de los aminoácidos consta de un grupo amino (-NH2), un grupo carboxilo (-COOH), un átomo de hidrógeno y una cadena lateral que varía entre los diferentes tipos de aminoácidos. La cadena lateral, también llamada “grupo R”, es única para cada aminoácido y le confiere propiedades químicas específicas.
La unión de aminoácidos mediante enlaces peptídicos da lugar a la formación de cadenas lineales llamadas polipéptidos, que, cuando se pliegan en una estructura tridimensional específica, constituyen proteínas. Las proteínas son cruciales para una variedad de funciones biológicas, incluyendo el soporte estructural, el transporte de sustancias, la función enzimática, la regulación del sistema inmunológico y muchas más.
Aminoácidos
Los aminoácidos son compuestos orgánicos esenciales para la vida y forman la base de las proteínas. Son moléculas compuestas por carbono, hidrógeno, oxígeno y nitrógeno, y en algunos casos, también contienen azufre. Los aminoácidos son los bloques de construcción fundamentales de las proteínas, que son macromoléculas esenciales para la estructura y función de las células.
Existen 20 aminoácidos que son comúnmente encontrados en las proteínas del cuerpo humano. Estos aminoácidos se clasifican en dos categorías principales:
- Aminoácidos Esenciales: El cuerpo no puede sintetizar estos aminoácidos por sí mismo, por lo que deben obtenerse a través de la dieta. Incluyen histidina, isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptófano y valina.
- Aminoácidos No Esenciales: El cuerpo puede sintetizar estos aminoácidos a partir de otras fuentes y no es necesario obtenerlos directamente de la dieta. Incluyen alanina, arginina, asparagina, ácido aspártico, cisteína, glutamina, ácido glutámico, glicina, prolina, serina y tirosina.
Características de los aminoácidos que forman proteínas
Los grupos funcionales de aminoácidos varían por tamaño. Los aminoácidos van desde las moléculas más pequeños, glicina, hasta las más grandes y abultadas, es decir, triptófano.
La mayoría de los aminoácidos se cristalizan como moléculas sin carga cuando se purifican y secan. Los pesos moleculares reflejan su peso molecular como aminoácidos cristalinos. Sin embargo, los aminoácidos básicos y acídicos tienden a formar cristales mucho más estables como sales más que como aminoácidos libres.
El ácido glutámico también se puede obtener como el aminoácido libre con un peso molecular de 147 y como su sal sódica, glutamato monosódico, que tiene un peso cristalino de 169.
La lisina se encuentra como una sal que contiene cloruro de hidrógeno.
Cuando los aminoácidos se representan por peso, es importante saber si el peso está basado en el aminoácido libre o en su sal.
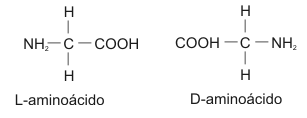
Otra propiedad importante de los aminoácidos es su actividad óptica. A excepción de la glicina, la cual tiene su grupo funcional como hidrógeno individual, todos los aminoácidos tienen al menos un centro quiral: el carbono-α. El término “quiral” proviene del griego mano, ya que estas moléculas tienen una lateralidad izquierda (“levo” o “L”) y derecha (“dextro” o “D”) alrededor del átomo de carbono-α.
Debido a la estructura tetraédrica de las uniones de carbono, hay dos posibles combinaciones de un centro de carbono con los mismos cuatro grupos diferentes unidos a él que no se superponen; las dos configuraciones, llamadas estereoisómeros, son imágenes espejadas la una de la otra.
El cuerpo humano reconoce solo la forma L del aminoácido para la mayoría de las reacciones, aunque algunas reacciones enzimáticas operarán con una eficiencia menor cuando se les da la forma D. Debido a que encontramos algunos aminoácidos de forma D en las comidas que consumimos, el cuerpo posee algunos mecanismos para eliminar estos aminoácidos a través de la filtración renal.
Solo 20 aminoácidos se incorporan directamente en las proteínas de mamíferos. Los aminoácidos se seleccionan para la síntesis de proteína cuando se emparejan para transferir ARNt. Para sintetizar proteína, se transcriben filamentos de ADN en los mensajeros ARN (ARNm). El ARNt se une al ARNm en grupos de 3 bases. Diferentes combinaciones de 3 moléculas de ARN consecutivas en el código ARNm para diferentes moléculas ARNt.
Las combinaciones de 3 bases de ARNm son reconocidas por solo 20 moléculas de ARNt diferentes, y 20 diferentes aminoácidos se incorporan en la proteína durante la síntesis proteica.
De estos 20 aminoácidos en las proteínas, algunas se sintetizan de novo en el cuerpo ya sea de otros aminoácidos o de precursores más simples. Estos aminoácidos pueden ser eliminados de nuestra dieta sin desmejorar la salud o bloquear el crecimiento. Estos aminoácidos son no indispensables y prescindibles de la dieta.
Para otros aminoácidos no existen vías para la síntesis de otros varios aminoácidos en los seres humanos, por consiguiente estos aminoácidos son esenciales o prescindibles para la dieta.
Características de los aminoácidos que forman proteínas
Algunos aminoácidos prescindibles pueden convertirse en condicionalmente indispensables en condiciones en que la síntesis se vuelve limitada o cuando cantidades adecuadas de precursores no están disponibles para alcanzar las necesidades del cuerpo.
Además de los 20 aminoácidos que son reconocidos por el ARNt para la incorporación en la proteína, otros aminoácidos aparecen comúnmente en el cuerpo. Estos aminoácidos tienen funciones metabólicas importantes. Son ejemplos la ornitina y citrulina, los cuales están ligados a la arginina a través del ciclo de la urea.
Otros aminoácidos aparecen como modificaciones de aminoácidos después de habe rsido incorporados en las proteínas. Por ejemplo, la hidroxiprolina y la hidroxilisina, los cuales se producen cuando los residuos de prolina y lisina en proteínas de colágenos se hidroxilan, y la 3-metilhistidina, que es producida por metilación postransaccional de residuos selectos de proteína de histidina, actina y miosina.
Debido a que no existe ARNt para codificar para estos aminoácidos, no pueden volver a usarse cuando una proteína que las contiene se rompe (hidroliza) en su aminoácido individual.
 Síguenos en X: @el_homomedicus y @enarm_intensivo
APRENDER CIRUGÍA
Síguenos en X: @el_homomedicus y @enarm_intensivo
APRENDER CIRUGÍA


















