La estrongiloidiasis es una infección causada por el nematodo Strongyloides stercoralis, un parásito que tiene la particularidad de poder completar su ciclo vital tanto dentro del huésped humano como en el ambiente externo, específicamente en el suelo. Aunque su prevalencia es menor en comparación con otras infecciones por helmintos como la ascariasis, la tricuriasis o la anquilostomiasis, la estrongiloidiasis representa un problema sanitario considerable, afectando a decenas de millones de personas, principalmente en regiones tropicales y subtropicales. Además, esta infección se encuentra de forma endémica en ciertas zonas templadas de América del Norte, Europa, Japón y Australia.
Una característica destacada de Strongyloides stercoralis es su capacidad para reproducirse dentro del organismo humano, lo que puede llevar a infecciones graves, particularmente en individuos con sistemas inmunológicos debilitados o comprometidos. Esta capacidad de replicación interna le permite al parásito mantener una infección persistente y autoinfectante, fenómeno que puede causar complicaciones clínicas severas. Otro parásito relacionado, Strongyloides fuelleborni, infecta a personas en algunas regiones de África y Nueva Guinea, aunque su impacto es más limitado en comparación con S. stercoralis.
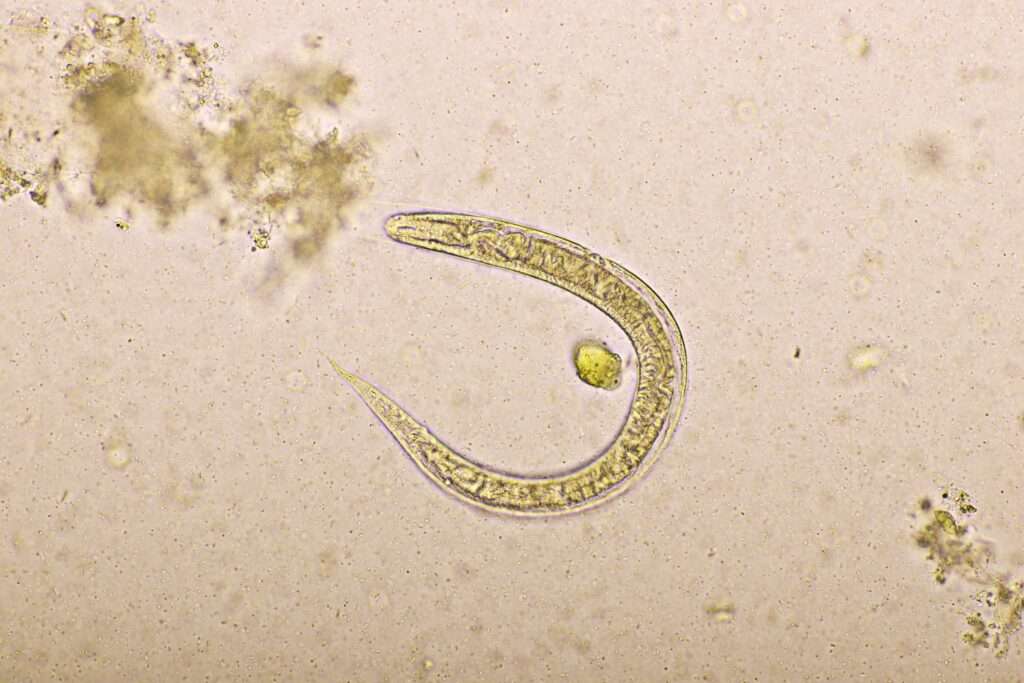
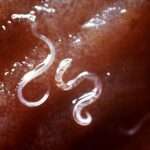
El proceso infeccioso inicia cuando las larvas filariformes, que son la forma infectante del parásito y se encuentran en el suelo húmedo, penetran la piel humana, usualmente a través de áreas expuestas como los pies. Tras atravesar la barrera cutánea, estas larvas ingresan al torrente sanguíneo y son transportadas hacia los pulmones. Allí, abandonan los capilares sanguíneos para ingresar en los alvéolos pulmonares. Desde esta ubicación, ascienden por el árbol bronquial hasta la faringe, donde son deglutidas y llegan al duodeno y al yeyuno proximal del intestino delgado, lugares donde maduran hasta convertirse en adultos.
Las hembras adultas de Strongyloides stercoralis se alojan incrustadas en la mucosa intestinal y pueden vivir hasta cinco años, liberando huevos que eclosionan dentro del intestino en larvas rabditoides. Estas larvas salen del cuerpo a través de las heces y, en condiciones de suelo húmedo y adecuado, se transforman en larvas filariformes infectantes, cerrando así el ciclo externo.
Un aspecto clínico y epidemiológico relevante es el fenómeno de la autoinfección, en el cual algunas larvas rabditoides que permanecen en el intestino evolucionan hacia larvas filariformes capaces de penetrar la mucosa intestinal o la piel perianal, reingresando nuevamente a la circulación sanguínea del mismo huésped. Este mecanismo permite la persistencia crónica de la infección sin necesidad de exposición ambiental adicional y puede conducir a cuadros clínicos especialmente graves, sobre todo en personas con inmunodeficiencias, quienes pueden desarrollar una forma diseminada potencialmente mortal.
El síndrome de hiperinfestación representa la manifestación clínica más grave y peligrosa de la infección por Strongyloides stercoralis. Esta condición se caracteriza por una diseminación masiva de larvas filariformes a los pulmones y a otros órganos y tejidos del cuerpo, un fenómeno que ocurre predominantemente en personas con un sistema inmunológico debilitado o comprometido. La gravedad de este síndrome radica en la multiplicación acelerada y descontrolada del parásito dentro del organismo, lo que lleva a una invasión extensiva que puede afectar múltiples sistemas corporales.
La mortalidad asociada con el síndrome de hiperinfestación es extremadamente alta. En ausencia de tratamiento, la tasa de muerte se aproxima al cien por ciento, lo que refleja la naturaleza fulminante y letal de esta complicación. Incluso con intervenciones médicas adecuadas, la tasa de supervivencia mejora pero sigue siendo preocupante, situándose alrededor del veinticinco por ciento, lo que subraya la dificultad para controlar esta infección en su forma más severa.
Este síndrome se observa con mayor frecuencia en individuos sometidos a tratamientos con corticosteroides y otros fármacos que suprimen la respuesta inmune, ya que estos medicamentos facilitan la replicación y diseminación del parásito al reducir las defensas naturales del organismo. Además, pacientes que padecen enfermedades hematológicas malignas, malnutrición severa, trastornos por consumo excesivo de alcohol o que viven con el virus de inmunodeficiencia humana en estadios avanzados, son particularmente susceptibles a desarrollar esta complicación. Entre estos grupos de riesgo, el uso de corticosteroides se destaca como el factor que incrementa de manera más significativa la probabilidad de presentar hiperinfestación.
En esencia, el síndrome de hiperinfestación refleja la capacidad única de Strongyloides stercoralis para multiplicarse dentro del cuerpo humano bajo condiciones de inmunosupresión, llevando a una invasión parasitaria masiva que provoca un cuadro clínico crítico, con altas tasas de mortalidad, y que requiere un diagnóstico oportuno y un manejo intensivo para mejorar las posibilidades de supervivencia.
Manifiestaciones clínicas
Al igual que ocurre con otros nematodos intestinales, la mayoría de las personas infectadas por Strongyloides stercoralispermanecen asintomáticas, lo que dificulta en muchos casos el diagnóstico temprano. Sin embargo, en la fase aguda de la infección, puede manifestarse un cuadro característico que inicia con una erupción cutánea pruriginosa, eritematosa y maculopapular, que típicamente aparece en la piel de los pies, lugar por donde suelen penetrar las larvas infectantes. Este síntoma inicial puede estar acompañado, después de varios días, por signos respiratorios como tos seca, dificultad para respirar y sibilancias, además de un aumento en el número de eosinófilos en sangre, reflejo de la respuesta inmunitaria del huésped. Posteriormente, a lo largo de algunas semanas, comienzan a aparecer síntomas gastrointestinales.
Durante la infección crónica, los pacientes pueden experimentar dolor en la región epigástrica, náuseas, diarrea y anemia, manifestaciones que reflejan la afectación continua del tracto digestivo por el parásito. Además, pueden observarse lesiones cutáneas en forma de erupciones maculopapulares o urticariales localizadas en áreas como los glúteos, perineo y muslos, causadas por la migración de larvas bajo la piel. Cuando la carga parasitaria es elevada, el daño intestinal puede ser tan severo que conduzca a problemas de malabsorción o incluso a la obstrucción intestinal, complicaciones que requieren atención médica urgente. La eosinofilia, aunque común, puede variar en intensidad durante el curso de la infección.
En los casos de hiperinfestación, la gravedad aumenta debido a la migración masiva de larvas hacia múltiples tejidos, incluyendo no solo los pulmones sino también el sistema nervioso central, los riñones y el hígado. Los síntomas gastrointestinales en estas circunstancias pueden intensificarse y abarcar dolor abdominal severo, náuseas, vómitos, diarrea profusa, así como manifestaciones más graves como obstrucción intestinal, perforación o hemorragia. Además, es frecuente la aparición de sepsis bacteriana, probablemente secundaria a ulceraciones y daño en la mucosa intestinal causados por la invasión parasitaria.
Las complicaciones pulmonares pueden incluir neumonitis, tos persistente, expectoración con sangre y falla respiratoria, siendo posible encontrar en el esputo formas adultas del parásito, larvas y huevos. En el sistema nervioso central, la infección puede manifestarse con meningitis o abscesos cerebrales, y el líquido cefalorraquídeo puede contener larvas del parásito, lo que indica diseminación avanzada. Las diversas formas clínicas pueden progresar rápidamente a un estado de shock y, en ausencia de un tratamiento oportuno y adecuado, conducir a la muerte.
Exámenes diagnósticos
El diagnóstico de la estrongiloidiasis representa un desafío clínico considerable debido a la naturaleza particular del parásito y su ciclo biológico. A diferencia de otros helmintos intestinales, los huevos de Strongyloides stercoralis rara vez se detectan en las muestras fecales, lo que dificulta la confirmación directa mediante métodos convencionales. Por lo tanto, el diagnóstico se basa principalmente en la identificación de las larvas rabditoides en las heces o en el contenido duodenal. Es fundamental distinguir estas larvas de las larvas de anquilostomas, ya que estas últimas pueden eclosionar después de la recolección de las muestras, lo que puede inducir a errores diagnósticos. Debido a que la sensibilidad de un único examen parasitológico es baja, aproximadamente del treinta por ciento, suele ser necesario realizar múltiples análisis de heces o recurrir a la evaluación del contenido duodenal para aumentar las probabilidades de detectar la infección.
En los casos de hiperinfestación, el diagnóstico se facilita por la presencia masiva de larvas filariformes, que pueden ser identificadas no solo en las heces, sino también en el esputo y otros fluidos corporales, reflejando la diseminación sistémica del parásito. Desde el punto de vista serológico, existen pruebas inmunoenzimáticas, como el ensayo ELISA desarrollado por los Centros para el Control y la Prevención de Enfermedades (CDC), que ofrecen una sensibilidad y especificidad cercanas al noventa por ciento. Sin embargo, es importante considerar la posibilidad de reacciones cruzadas con otros helmintos, lo que puede generar resultados falsos positivos y complicar la interpretación clínica. Por otro lado, las técnicas moleculares, como la reacción en cadena de la polimerasa y métodos relacionados, han demostrado ser herramientas valiosas para confirmar la presencia del parásito con alta precisión.
En cuanto a los hallazgos de laboratorio, la eosinofilia y la anemia leve son comunes en la estrongiloidiasis crónica, pero en situaciones de hiperinfestación, la eosinofilia puede estar ausente, posiblemente debido a la supresión inmunitaria asociada. Además, el cuadro clínico de hiperinfestación suele acompañarse de infiltrados pulmonares extensos visibles en estudios radiológicos, hipoproteinemia y alteraciones en las pruebas de función hepática, reflejando la gravedad y extensión multisistémica de la infección.
Desde una perspectiva preventiva y clínica, es fundamental considerar la posibilidad de estrongiloidiasis en personas con antecedentes, aunque remotos, de residencia en áreas endémicas, dado que la infección puede permanecer latente durante décadas sin manifestaciones evidentes. Por esta razón, la realización de pruebas de tamizaje en individuos en riesgo resulta crucial, especialmente antes de iniciar tratamientos inmunosupresores, ya que la supresión del sistema inmune puede desencadenar formas graves de la enfermedad. El cribado puede llevarse a cabo mediante pruebas serológicas, complementadas con exámenes fecales en aquellos casos con resultados positivos. Sin embargo, en algunos escenarios, la administración empírica de tratamiento está justificada incluso si los exámenes parasitológicos resultan negativos, con el fin de prevenir la evolución hacia cuadros clínicos severos.
Tratamiento
La erradicación completa de Strongyloides stercoralis cobra una importancia crítica que la diferencia de otras infecciones por helmintos intestinales, principalmente debido a la capacidad única de este parásito para reproducirse dentro del organismo humano. Esta habilidad para mantener un ciclo de vida autoinfectante genera un riesgo continuo de persistencia y recurrencia de la infección, lo que puede conducir a complicaciones graves, especialmente en individuos inmunocomprometidos. Por esta razón, el objetivo terapéutico debe ser la eliminación total del parásito para prevenir tanto la infección crónica como la aparición de formas clínicas severas.
El tratamiento de primera elección para la infección rutinaria por S. stercoralis es la ivermectina, un agente antiparasitario que se administra por vía oral en una dosis de 200 microgramos por kilogramo de peso corporal, generalmente durante uno o dos días. Este fármaco ha demostrado una eficacia superior y un perfil de seguridad favorable en comparación con otras opciones terapéuticas. Entre las alternativas disponibles, aunque menos eficaces, se encuentran el albendazol, que se prescribe a una dosis de 400 miligramos dos veces al día durante tres días, y el tiabendazol, con una dosis de 25 miligramos por kilogramo administrados dos veces al día también por tres días. Estas opciones pueden ser utilizadas en casos donde la ivermectina no esté disponible o esté contraindicada, pero suelen presentar mayores efectos secundarios y menor eficacia.
En situaciones de hiperinfestación, el manejo terapéutico requiere un enfoque más intensivo y prolongado. La ivermectina debe administrarse diariamente hasta que los signos clínicos de la enfermedad hayan desaparecido completamente y no se detecten larvas en las muestras de heces o esputo durante al menos dos semanas consecutivas. La vigilancia mediante exámenes periódicos es esencial para asegurar la eliminación efectiva del parásito, y si persiste la infección, es necesario repetir las dosis del medicamento. En pacientes sometidos a inmunosupresión continua, la erradicación puede ser especialmente difícil, dado que el sistema inmune comprometido facilita la supervivencia y multiplicación del parásito. En estos casos, puede requerirse la administración periódica y repetida de ivermectina, por ejemplo, de forma mensual, para mantener el control de la infección y prevenir complicaciones graves.

Fuente y lecturas recomendadas:
- Goldman, L., & Schafer, A. I. (Eds.). (2020). Goldman-Cecil Medicine (26th ed.). Elsevier.
- Loscalzo, J., Fauci, A. S., Kasper, D. L., Hauser, S. L., Longo, D. L., & Jameson, J. L. (Eds.). (2022). Harrison. Principios de medicina interna (21.ª ed.). McGraw-Hill Education.
- Papadakis, M. A., McPhee, S. J., Rabow, M. W., & McQuaid, K. R. (Eds.). (2024). Diagnóstico clínico y tratamiento 2025. McGraw Hill.
- Rozman, C., & Cardellach López, F. (Eds.). (2024). Medicina interna (20.ª ed.). Elsevier España.