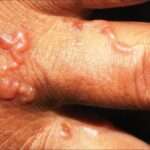
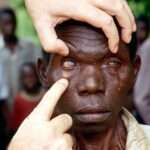
La filariasis linfática es una enfermedad parasitaria causada por tres especies de nematodos filariales: Wuchereria bancrofti, Brugia malayi y Brugia timori. Esta patología se encuentra entre las más relevantes dentro del grupo de enfermedades parasitarias que afectan al ser humano. Se estima que alrededor de 120 millones de personas en regiones tropicales y subtropicales están infectadas por estos parásitos, y aproximadamente un tercio de ellas desarrolla manifestaciones clínicas que pueden llevar a deformidades graves y discapacitantes.
La especie Wuchereria bancrofti es responsable de cerca del 90 % de los casos de filariasis linfática a nivel mundial. La transmisión de este parásito ocurre principalmente a través de la picadura de mosquitos de los géneros Culex, Aedes y Anopheles, insectos que están ampliamente distribuidos en las zonas tropicales y subtropicales, incluyendo regiones como el África subsahariana, el sudeste asiático, el Pacífico occidental, India, Sudamérica y el Caribe.
Por su parte, Brugia malayi es transmitida por mosquitos de los géneros Mansonia y Anopheles, y su presencia se restringe a ciertas áreas endémicas, como partes de China, India, el sudeste asiático y algunas islas del Pacífico. La tercera especie, Brugia timori, tiene una distribución geográfica mucho más limitada, encontrándose únicamente en algunas islas del sureste de Indonesia.
Es importante destacar que otros nematodos filariales del género Mansonella, transmitidos por jejenes y otros insectos hematófagos, también pueden infectar a humanos en ciertas regiones de África y Sudamérica, aunque estos no son responsables de la filariasis linfática.
El proceso infeccioso inicia cuando un mosquito infectado pica a una persona, inoculando las larvas del parásito en la piel. Estas larvas migran hacia los vasos linfáticos y ganglios linfáticos, donde maduran lentamente durante varios meses hasta convertirse en gusanos adultos, delgados y alargados, que pueden persistir en el organismo durante muchos años. Los adultos producen grandes cantidades de microfilarias, que son liberadas en la circulación sanguínea. Estas microfilarias presentan un patrón de periodicidad que facilita su transmisión, apareciendo en mayor concentración en la sangre en ciertos momentos del día, generalmente durante la noche, lo que coincide con la actividad de los mosquitos vectores. Sin embargo, en regiones del Pacífico Sur, esta periodicidad se invierte, presentándose un pico durante las horas diurnas.
Manifestaciones clínicas
Aunque muchas personas infectadas con filarias presentan microfilarias circulantes en sangre, en numerosos casos la infección permanece asintomática, sin manifestar síntomas evidentes. Las complicaciones clínicas asociadas a la filariasis se deben fundamentalmente a las respuestas inflamatorias del organismo frente a las diferentes etapas del parásito: larvas en desarrollo, gusanos adultos maduros y los parásitos moribundos. Estas reacciones inflamatorias son responsables de la mayoría de las manifestaciones clínicas y daños tisulares.
El cuadro inicial de la infección suele ser una linfangitis aguda, caracterizada por fiebre, dolor y aumento de volumen en los ganglios linfáticos, además de edema e inflamación que se extiende desde los ganglios afectados hacia las áreas periféricas. Esta forma de inflamación se diferencia de la linfangitis bacteriana, que típicamente se propaga en dirección central. La linfangitis y linfadenitis afectan comúnmente las extremidades superiores e inferiores, y en casos específicos de infección por Wuchereria bancrofti pueden involucrarse órganos genitales, manifestándose como epididimitis y orquitis, acompañadas de dolor y sensibilidad en el escroto.
Los episodios agudos de linfangitis suelen durar desde algunos días hasta una semana y pueden repetirse varias veces al año, con episodios febriles que en ocasiones ocurren sin inflamación linfática aparente. Con el tiempo, la inflamación persistente y la obstrucción del sistema linfático conducen a las manifestaciones crónicas más comunes de la filariasis linfática: el aumento progresivo de volumen en las extremidades o en los genitales. Este edema puede ser con fóvea (que deja una hendidura al presionar) o sin fóvea, acompañado en etapas avanzadas por cambios esclerosantes en la piel, condición conocida como elefantiasis.
El compromiso genital, especialmente en infecciones por Wuchereria bancrofti, es más frecuente en hombres y se presenta como un proceso que va desde la epididimitis dolorosa hasta la formación de hidroceles, que generalmente no producen dolor pero pueden alcanzar gran tamaño. Además, pueden aparecer linfadenopatías inguinales, engrosamiento del cordón espermático, linfedema escrotal, así como engrosamiento y fisuración de la piel escrotal, y en ocasiones la presencia de quiluria, que es la salida de linfa a través de la orina. En las mujeres, también pueden observarse linfedema en los genitales externos y en las mamas.
Por otro lado, existe un síndrome conocido como eosinofilia pulmonar tropical, que afecta principalmente a hombres jóvenes infectados con Wuchereria bancrofti o Brugia malayi. Este cuadro se caracteriza por síntomas similares al asma, incluyendo tos, sibilancias, dificultad respiratoria y fiebre leve, que suelen empeorar durante la noche. A diferencia de la filariasis linfática clásica, en este síndrome es raro encontrar microfilarias en sangre. Si no se trata, la eosinofilia pulmonar tropical puede evolucionar hacia fibrosis intersticial pulmonar y una enfermedad pulmonar restrictiva crónica, con deterioro progresivo de la función respiratoria.
Otros nematodos filariales del género Mansonella pueden habitar cavidades serosas, el retroperitoneo, el ojo o la piel, causando diversas alteraciones clínicas derivadas de la inflamación en estos sitios específicos. Estos parásitos contribuyen a un espectro diferente de manifestaciones clínicas, muchas veces menos estudiadas pero igualmente relevantes en las regiones donde están presentes.
Exámenes diagnósticos
El diagnóstico de la filariasis linfática se basa fundamentalmente en la identificación clínica de signos característicos, como linfangitis o signos de obstrucción linfática, en personas que presentan factores de riesgo epidemiológicos para esta enfermedad. Estas manifestaciones clínicas sugieren fuertemente la presencia de la infección, aunque para confirmar el diagnóstico es necesario detectar la presencia de microfilarias, principalmente en muestras de sangre. Sin embargo, es importante destacar que las microfilarias pueden no estar presentes en la circulación, especialmente en las etapas iniciales de la infección, durante los primeros dos o tres años, o en fases avanzadas con enfermedad obstructiva crónica.
Para maximizar la probabilidad de detectar las microfilarias, las muestras de sangre se recolectan en horarios específicos que coinciden con la periodicidad de la microfilaremia. En la mayoría de las regiones endémicas, la toma se realiza alrededor de la medianoche, cuando la concentración de microfilarias en sangre es máxima. No obstante, en las áreas del Pacífico Sur, esta toma se efectúa durante el día, debido a un patrón diferente de periodicidad. El análisis se lleva a cabo mediante extensiones sanguíneas, utilizando preparaciones en fresco para observar los parásitos móviles, así como coloraciones con Giemsa que permiten una identificación más detallada. Estas muestras pueden conservarse a temperatura ambiente hasta el día siguiente para facilitar su procesamiento.
Cabe señalar que la periodicidad de la microfilaremia no es uniforme, por lo que también es posible obtener resultados positivos en muestras tomadas durante el día. Además, las microfilarias pueden detectarse en otros fluidos, como el líquido de hidroceles o en orina quilosa, ampliando las posibilidades diagnósticas en casos específicos.
En cuanto a los análisis de laboratorio, la eosinofilia, un marcador común de infecciones parasitarias, generalmente está ausente en la filariasis linfática, salvo durante episodios inflamatorios agudos. Los métodos serológicos pueden ser útiles para la detección de anticuerpos, aunque no permiten diferenciar entre infecciones actuales y previas, limitando su utilidad clínica.
Por otro lado, se han desarrollado pruebas rápidas de detección de antígenos específicos de Wuchereria bancrofti que presentan una sensibilidad y especificidad superiores al noventa por ciento. Estas pruebas son actualmente las más recomendadas para el diagnóstico y se utilizan también para orientar programas de control y erradicación. Sin embargo, se ha documentado que estas pruebas pueden presentar reactividad cruzada en personas infectadas con Loa loa, lo que requiere precaución al interpretar resultados en áreas donde ambas infecciones coexisten. En estos contextos, es fundamental evaluar cuidadosamente el riesgo de toxicidad grave que puede surgir tras el tratamiento con ivermectina en pacientes positivos para Wuchereria bancrofti que también tengan infección por Loa loa.
Asimismo, existen múltiples técnicas moleculares, incluyendo ensayos de amplificación isotérmica como LAMP, que son accesibles incluso en condiciones de campo y permiten la detección precisa del material genético del parásito.
En ocasiones, la identificación de los gusanos adultos puede lograrse a través de biopsias de ganglios linfáticos, aunque esta práctica no es común debido a su carácter invasivo y a que no suele ser necesaria para el manejo clínico. Alternativamente, el ultrasonido puede revelar la presencia de gusanos en hidroceles escrotales o en tejidos mamarios afectados por linfedema.
Cuando no se detectan microfilarias y no se cuenta con técnicas diagnósticas sofisticadas, el diagnóstico debe basarse principalmente en la evaluación clínica, considerando el contexto epidemiológico y las manifestaciones típicas del paciente, para tomar decisiones oportunas de tratamiento y control.
Tratamiento
El tratamiento farmacológico de la filariasis linfática se basa principalmente en el uso de dietilcarbamazina, que es el fármaco de elección para esta infección. No obstante, esta medicación no logra erradicar completamente la infección debido a su acción limitada contra los gusanos adultos, concentrándose principalmente en la eliminación de las microfilarias circulantes. En casos de infección asintomática o durante episodios de linfangitis aguda, la dietilcarbamazina se administra por vía oral en una dosis de dos miligramos por kilogramo de peso corporal, tres veces al día durante un período de diez a catorce días. Este régimen produce una reducción significativa en la cantidad de microfilarias presentes en la sangre.
Es importante señalar que el tratamiento con dietilcarbamazina puede desencadenar una reacción alérgica debido a la liberación de antígenos provenientes de los parásitos muertos, manifestándose con fiebre, cefalea, malestar general, hipotensión y broncoespasmo. Por esta razón, se recomienda iniciar el tratamiento con dosis más bajas, aumentando gradualmente la dosis durante los primeros cuatro días para minimizar la intensidad de estos efectos adversos.
Además del tratamiento prolongado, se ha demostrado que la administración de dosis únicas anuales de dietilcarbamazina, con una dosis aproximada de seis miligramos por kilogramo, sola o en combinación con ivermectina o albendazol, puede ser tan eficaz como los cursos prolongados de dietilcarbamazina. En particular, la terapia combinada que incluye una dosis única de ivermectina, dietilcarbamazina y albendazol —conocida como régimen IDA— ha logrado eliminar los parásitos en más del noventa y cinco por ciento de los pacientes durante un periodo de hasta tres años, mostrando una mayor eficacia que la combinación de dos medicamentos y con un perfil de seguridad y tolerabilidad favorable.
En áreas donde existe sospecha de onchocerciasis o loiasis, se recomienda precaución antes de administrar dietilcarbamazina, debido al riesgo de reacciones severas causadas por la muerte masiva de microfilarias. En tales casos, puede ser preferible utilizar ivermectina en combinación con albendazol, aunque estos medicamentos tienen menor eficacia frente a los gusanos adultos.
El manejo de la enfermedad avanzada, caracterizada por obstrucción linfática crónica, sigue siendo un desafío. El drenaje quirúrgico de hidroceles puede proporcionar alivio sintomático, aunque existe la posibilidad de recurrencia. Aunque el tratamiento con dietilcarbamazina no puede revertir los daños crónicos del sistema linfático, su uso sigue siendo fundamental para reducir la carga parasitaria en el organismo.
Una estrategia terapéutica innovadora bajo investigación consiste en el uso de doxiciclina, administrada en dosis de cien a doscientos miligramos diarios durante cuatro a seis semanas. Esta antibiótico actúa eliminando las bacterias intracelulares obligadas del género Wolbachia, que mantienen una relación simbiótica con los nematodos filariales. Al destruir estas bacterias, se induce la muerte progresiva de los gusanos adultos. Además, la doxiciclina ha demostrado ser efectiva en el tratamiento de infecciones por Mansonella perstans, las cuales responden pobremente a los tratamientos antifilariales convencionales.
El manejo clínico debe también incluir el tratamiento adecuado de infecciones bacterianas secundarias, que pueden complicar el curso de la enfermedad. En ciertos casos, la corrección quirúrgica puede ser necesaria para mejorar la calidad de vida de los pacientes afectados.
En términos de control de la enfermedad, la prevención basada en la reducción del contacto con los mosquitos vectores es esencial. Entre las medidas más eficaces se encuentran el uso de mosquiteros tratados con insecticidas, la instalación de mallas protectoras en ventanas y puertas, y la aplicación de repelentes de insectos. A nivel comunitario, la administración anual de dosis únicas de medicamentos efectivos constituye una estrategia altamente eficiente para el control de la filariasis linfática. La terapia combinada IDA representa un avance significativo en la eficacia de estos programas y podría establecerse como el estándar en la prevención de esta enfermedad a largo plazo.

Fuente y lecturas recomendadas:
- Goldman, L., & Schafer, A. I. (Eds.). (2020). Goldman-Cecil Medicine (26th ed.). Elsevier.
- Loscalzo, J., Fauci, A. S., Kasper, D. L., Hauser, S. L., Longo, D. L., & Jameson, J. L. (Eds.). (2022). Harrison. Principios de medicina interna (21.ª ed.). McGraw-Hill Education.
- Papadakis, M. A., McPhee, S. J., Rabow, M. W., & McQuaid, K. R. (Eds.). (2024). Diagnóstico clínico y tratamiento 2025. McGraw Hill.
- Rozman, C., & Cardellach López, F. (Eds.). (2024). Medicina interna (20.ª ed.). Elsevier España.
- Weil GJ et al. The safety of double- and triple-drug community mass drug administration for lymphatic filariasis: a multicenter, open-label, cluster-randomized study. PLoS Med. 2019;16:e1002839. [PMID: 31233507]