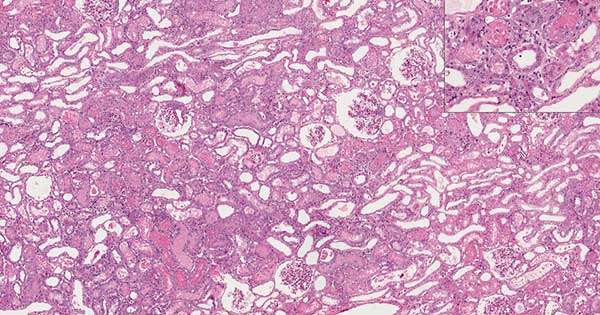
La Lesión Renal Aguda debida a daño tubular se conoce comúnmente como necrosis tubular aguda. Este término describe una condición patológica en la que los túbulos renales, la parte del riñón encargada de reabsorber agua, electrolitos y otras sustancias del filtrado, sufren daño y posterior muerte celular. Los riñones están formados por una serie de estructuras interconectadas, que incluyen los glomérulos, los túbulos renales y los vasos sanguíneos. Cuando estas estructuras tubulares se lesionan, los riñones pierden su capacidad para filtrar la sangre de manera eficiente y mantener la homeostasis, lo que da lugar a la manifestación de la Lesión Renal Aguda.
El término necrosis tubular aguda se utiliza para describir un patrón particular de lesión renal caracterizado por la destrucción de las células epiteliales tubulares, que puede ocurrir a través de diversos mecanismos. El daño a estas células es particularmente significativo porque desempeñan un papel esencial en el mantenimiento del equilibrio de líquidos y electrolitos, en la regulación de la presión arterial y en la eliminación de productos de desecho del cuerpo. Cuando estas células se vuelven necróticas, o mueren, se ve afectada la capacidad del riñón para funcionar, lo que provoca la acumulación de productos de desecho y líquidos en el cuerpo.
Una de las razones más importantes por las que esta condición se denomina necrosis tubular aguda es el daño irreversible que puede ocurrir en los túbulos renales en esta forma de Lesión Renal Aguda. Este tipo de lesión tubular puede ser causado por varios factores, como la isquemia renal prolongada, la exposición a nefrotoxinas o la sepsis, y representa aproximadamente el 85% de los casos de Lesión Renal Aguda intrínseca, lo que la convierte en la forma más prevalente de Lesión Renal Aguda entre los pacientes hospitalizados.
La isquemia renal, que ocurre cuando hay una reducción del flujo sanguíneo hacia los riñones, es una de las principales causas de la Necrosis Tubular Aguda. Los riñones dependen en gran medida de un suministro constante de sangre, y cuando este flujo sanguíneo se ve reducido o interrumpido, el tejido renal puede quedar privado de oxígeno y nutrientes, lo que lleva a lesiones celulares y necrosis. La isquemia prolongada, como la que puede ocurrir durante cirugías importantes, shock o insuficiencia cardíaca, es particularmente perjudicial para los túbulos renales, que son más vulnerables a las lesiones isquémicas que otras partes del riñón.
La exposición a nefrotoxinas es otra causa significativa de Necrosis Tubular Aguda. Las nefrotoxinas son sustancias que tienen un efecto tóxico sobre las células renales. Estas toxinas pueden ser medicamentos, como ciertos antibióticos, tintes de contraste utilizados en procedimientos de imágenes o sustancias ilícitas, todas las cuales pueden dañar directamente los túbulos renales. Los efectos tóxicos típicamente conducen a inflamación, estrés oxidativo y daño directo a las células epiteliales tubulares, lo que finalmente lleva a su muerte. Este proceso puede deteriorar rápidamente la función renal, lo que a menudo resulta en Lesión Renal Aguda.
La sepsis, incluso en pacientes normotensos, es otro desencadenante común de la Necrosis Tubular Aguda. En la sepsis, una infección provoca una inflamación sistémica y una respuesta inmune desmesurada. Los mediadores inflamatorios que se liberan durante la sepsis pueden causar daño endotelial generalizado, alterar el equilibrio de líquidos y electrolitos y dificultar la perfusión renal, lo que lleva finalmente a un daño tubular. Curiosamente, incluso los pacientes con presión arterial normal pueden desarrollar Necrosis Tubular Aguda durante la sepsis, ya que los procesos inflamatorios en sí mismos, en lugar de la hipotensión aislada, pueden afectar significativamente la función renal.
La fisiopatología de la Necrosis Tubular Aguda involucra una cascada de eventos que conducen al daño y la disfunción tubular. La lesión inicial puede implicar disfunción de las células endoteliales y la activación de vías inflamatorias, lo que lleva a una mayor reducción del flujo sanguíneo renal. Esta reducción del suministro sanguíneo agrava la lesión isquémica, desencadenando un ciclo de retroalimentación de inflamación incrementada, estrés oxidativo y necrosis de las células tubulares. Una vez que las células tubulares se lesionan, liberan sustancias nocivas en el torrente sanguíneo, lo que complica aún más el equilibrio homeostático del cuerpo. Esta cascada puede dar lugar a la pérdida de la función tubular y al desarrollo de insuficiencia renal aguda, caracterizada por la incapacidad de los riñones para excretar productos de desecho y mantener el equilibrio de líquidos.
Nefrotoxinas exógenas
Los nefrotoxinas exógenas son más comúnmente responsables de causar necrosis tubular aguda que las nefrotoxinas endógenas. La necrosis tubular aguda es una forma prevalente de lesión renal aguda intrínseca, y las nefrotoxinas exógenas, en particular, tienen un impacto importante en su desarrollo. Un ejemplo común de nefrotoxinas exógenas son los aminoglucósidos, que pueden causar necrosis tubular aguda incluso cuando se administran a niveles terapéuticos. Estos medicamentos son conocidos por su potencial nefrotóxico, que se manifiesta típicamente en un período de 5 a 10 días de exposición al fármaco, lo que da lugar a una forma no oligurica de lesión renal aguda.
El riesgo de daño renal debido a estos fármacos está influenciado por factores predisponentes, como la enfermedad renal preexistente, la depleción de volumen y la edad avanzada. Por lo tanto, es crucial realizar un monitoreo adecuado de los niveles de los medicamentos para identificar posibles indicios de toxicidad renal. En el caso de los aminoglucósidos, la medición de los niveles en el punto más bajo de concentración, conocido como «trough», puede ser útil para predecir la toxicidad renal, permitiendo la intervención antes de que se produzca un daño irreparable.
Otro fármaco que es particularmente nefrotóxico es la anfotericina B, la cual puede causar daño renal significativo después de una dosis total de 2 a 3 gramos. La nefrotoxicidad de la anfotericina B se asocia con una acidosis tubular renal tipo 1 (distal), que se caracteriza por severa vasoconstricción y daño tubular. Esto puede derivar en hipokalemia y diabetes insípida nefrogénica, dos complicaciones graves que agravan la insuficiencia renal. Además de estos medicamentos, otros fármacos como la vancomicina, el aciclovir intravenoso y las cefalosporinas también se conocen por su capacidad para inducir necrosis tubular aguda o estar asociados con su aparición.
Los medios de contraste radiográficos también tienen el potencial de ser nefrotóxicos, y la nefropatía por contraste se refiere a un aumento en los niveles de creatinina que ocurre típicamente entre 24 y 48 horas después de la administración del contraste. La lesión renal asociada a la exposición al contraste se produce como resultado de la combinación sinérgica de toxicidad directa sobre las células epiteliales tubulares renales y la isquemia de la médula renal en individuos susceptibles. Los factores de riesgo para esta condición incluyen la presencia de diabetes mellitus preexistente e insuficiencia renal crónica, con un riesgo aún mayor si se combinan estos factores con la edad avanzada, la depleción de volumen, la insuficiencia cardíaca, el mieloma múltiple, las dosis repetidas de contraste y la exposición reciente a fármacos que afectan la autorregulación renal, como los antiinflamatorios no esteroides, los inhibidores de la enzima convertidora de angiotensina y los bloqueadores de los receptores de angiotensina, y los inhibidores de SGLT-2.
La prevención de la nefropatía por contraste en pacientes con alto riesgo de lesión incluye el uso de volúmenes de contraste más bajos con la menor osmolalidad posible. Además, se recomienda la infusión de líquidos intravenosos, generalmente solución salina normal, administrada a razón de 3 mililitros por kilogramo por hora durante 1 hora antes de la administración del contraste, y 1 mililitro por kilogramo por hora durante 4 a 6 horas después de la administración del contraste en pacientes que puedan tolerar este volumen. Aumentar la ingesta oral de líquidos es una alternativa, aunque se considera menos protectora. Si el paciente lo tolera, es posible suspender el uso de diuréticos antes de la administración del contraste. Estrategias profilácticas alternativas como la N-acetilcisteína, el bicarbonato de sodio, el manitol y la furosemida no han demostrado ser más efectivas que la administración de solución salina normal.
La toxicidad por inhibidores de la calcineurina, como el tacrolimus o la ciclosporina, generalmente es dependiente de la dosis y causa disfunción tubular distal (una forma de acidosis tubular renal tipo 4) y vasoconstricción severa. El monitoreo regular de los niveles sanguíneos es fundamental para prevenir tanto la nefrotoxicidad aguda como la crónica. La disfunción renal aguda generalmente mejora después de reducir la dosis o suspender el medicamento.
Otros agentes exógenos que pueden causar necrosis tubular aguda incluyen agentes quimioterapéuticos como el cisplatino, solventes orgánicos y metales pesados como el mercurio, el cadmio y el arsénico. Los inhibidores de la enzima convertidora de angiotensina, los bloqueadores de los receptores de angiotensina y los inhibidores de SGLT-2 tienen muchos beneficios a largo plazo para los pacientes con enfermedad renal crónica, pero en ocasiones pueden causar o contribuir a la necrosis tubular aguda isquémica en situaciones de hipotensión prolongada o depleción de volumen. Además, las medicinas herbales están siendo cada vez más reconocidas como potencialmente nefrotóxicas, lo que agrega otra capa de complejidad en el manejo de los pacientes con riesgo de lesión renal.
Nefrotoxinas endógenas
Las nefrotoxinas endógenas incluyen pigmentos como la mioglobina y la hemoglobina, ácido úrico y paraproteínas. Estos productos pueden causar toxicidad directa sobre los túbulos renales, lo que puede resultar en necrosis tubular aguda. El tipo más común de nefropatía pigmentaria es la rabdomiolisis, que se produce por la liberación de mioglobina desde el músculo esquelético hacia el torrente sanguíneo. Esta condición ocurre cuando hay una lesión muscular extensa que provoca la liberación masiva de mioglobina, una proteína que, al llegar a los riñones, puede inducir daño directo a las células tubulares y provocar necrosis tubular aguda.
La hemoglobina, que se libera durante la hemólisis intravascular masiva, también puede causar daño renal significativo. Este fenómeno se observa en reacciones a transfusiones sanguíneas y en ciertas anemias hemolíticas, donde la destrucción de los glóbulos rojos genera grandes cantidades de hemoglobina que circulan en la sangre. La hemoglobina liberada se filtra a través de los riñones, donde se precipita y causa daño a las células tubulares renales, lo que puede dar lugar a necrosis tubular aguda. El tratamiento para estas condiciones incluye la remisión del trastorno subyacente y la reanimación con líquidos para ayudar a diluir y eliminar estos pigmentos tóxicos de los riñones.
La hiperuricemia es otro factor endógeno que puede inducir necrosis tubular aguda, especialmente en contextos de rápida rotura celular y lisis. Un ejemplo claro de este fenómeno ocurre durante el tratamiento de quimioterapia para malignidades de células germinales y hematológicas, como leucemia y linfoma, donde la rápida destrucción de células tumorales provoca un aumento masivo de ácido úrico en el suero, condición conocida como síndrome de lisis tumoral. Aunque menos frecuente, el síndrome de lisis tumoral espontáneo también puede ocurrir. Cuando los niveles de ácido úrico en el suero superan los 15–20 mg/dL, los cristales de ácido úrico pueden precipitarse dentro de los túbulos renales, lo que resulta en la obstrucción tubular y la posterior necrosis tubular aguda. Para prevenir esta complicación, se utilizan tratamientos profilácticos como el alopurinol o el rasburicasa, y en los casos establecidos, el rasburicasa, con o sin diálisis, es comúnmente utilizado para reducir los niveles de ácido úrico y minimizar el daño renal.
Las paraproteínas, que se encuentran en el mieloma de células plasmáticas, también pueden causar toxicidad directa sobre los túbulos renales. Estas proteínas anormales, producidas en exceso por las células plasmáticas malignas, pueden depositarse en los túbulos renales y obstruirlos, lo que conduce a una disfunción renal. Además de la nefropatía inducida por paraproteínas, el mieloma de células plasmáticas puede causar otras complicaciones renales, como la hipercalcemia y disfunción tubular renal. Esta disfunción renal suele manifestarse como acidosis tubular renal tipo 2 (proximal), que afecta la capacidad de los túbulos proximales para reabsorber el bicarbonato, resultando en un trastorno ácido-base.
Exámenes diagnósticos
Los hallazgos de laboratorio suelen ser característicos de la disfunción tubular renal. Uno de los principales hallazgos es la presencia de hiperpotasemia e hiperfosfatemia. La hiperpotasemia, o aumento de los niveles de potasio en sangre, es frecuente debido a la incapacidad de los túbulos renales para excretar adecuadamente este ion, lo que se ve exacerbado por el daño tubular. De manera similar, la hiperfosfatemia, o niveles elevados de fósforo en sangre, es otro marcador típico, ya que los riñones, que juegan un papel crucial en la excreción de fosfatos, pierden su capacidad de filtrar este ion eficientemente en presencia de necrosis tubular aguda.
Otro hallazgo importante es la relación nitrógeno ureico en sangre:creatinina, que generalmente es inferior a 20:1 en la necrosis tubular aguda. Esta relación, que suele ser más alta en otras formas de lesión renal aguda, se encuentra reducida en casos de necrosis tubular aguda porque la función tubular se encuentra comprometida. En la necrosis tubular aguda, la capacidad de los túbulos renales para concentrar la orina y regular la eliminación de solutos se ve afectada, lo que resulta en una menor reabsorción de agua y solutos y, por lo tanto, una menor reabsorción de nitrógeno ureico.
La concentración de sodio en la orina y la fracción de excreción de sodio también suelen estar elevadas, aunque no siempre de manera uniforme. Estos indicadores sugieren que los túbulos renales están incapaces de reabsorber de manera adecuada el sodio filtrado, lo que es característico de la disfunción tubular en la necrosis tubular aguda. La fracción de excreción de sodio es un parámetro particularmente útil para evaluar la función tubular, ya que refleja la cantidad de sodio que se excreta en relación con la cantidad filtrada por los riñones. En casos de necrosis tubular aguda, esta fracción tiende a estar aumentada debido a la incapacidad de los túbulos renales para retener sodio.
En cuanto a la microscopía urinaria, esta puede revelar evidencia de daño tubular agudo. En particular, la presencia de dos o más cilindros granulosos o células epiteliales tubulares renales en el sedimento urinario es un hallazgo fuertemente predictivo de necrosis tubular aguda. Los cilindros granulosos son fragmentos de células tubulares que se han desintegrado y que se encuentran en la orina como resultado de la muerte celular en los túbulos renales. Aunque la presencia de estos hallazgos es indicativa de necrosis tubular aguda, es importante señalar que el valor predictivo negativo de estos hallazgos es bajo, lo que significa que la ausencia de estos signos no descarta completamente la presencia de necrosis tubular aguda.
En algunos casos de duda diagnóstica, la biopsia renal puede ser útil para confirmar el diagnóstico de necrosis tubular aguda, aunque generalmente no se realiza en casos sospechosos de esta condición, dado que los hallazgos clínicos y de laboratorio suelen ser suficientes para llegar a un diagnóstico. La biopsia renal puede ser necesaria en situaciones en las que el diagnóstico sea incierto o cuando se requiera diferenciar la necrosis tubular aguda de otras enfermedades renales que pueden presentar hallazgos similares en los estudios de laboratorio.
Tratamiento
El tratamiento de la necrosis tubular aguda está enfocado en acelerar la recuperación del riñón y evitar complicaciones adicionales que puedan surgir a lo largo del proceso de recuperación. Las medidas preventivas son fundamentales para evitar problemas como la sobrecarga de volumen y la hiperpotasemia, que son complicaciones comunes en los pacientes con lesión renal aguda debido a la necrosis tubular aguda.
A pesar de que los diuréticos de asa, como la furosemida, se utilizan con frecuencia en estos pacientes, un ensayo clínico prospectivo aleatorizado controlado (RCT) no mostró beneficios en cuanto a la mejora de la recuperación de la lesión renal aguda ni en la reducción de la mortalidad. Por lo tanto, el uso de diuréticos en pacientes críticamente enfermos con lesión renal aguda debe limitarse a aquellos casos en los que haya una indicación clínica clara, como en situaciones de sobrecarga de volumen. Es relevante que la falta de respuesta a un ensayo con diuréticos a altas dosis, conocido como «prueba de estrés con furosemida», se ha asociado con la predicción de la necesidad futura de diálisis en este grupo de pacientes.
La ultrafiltración es una opción terapéutica que se reserva generalmente para los pacientes con lesión renal aguda que requieren eliminación de volumen, pero que no responden a los diuréticos. Sin embargo, aunque esta técnica puede ser útil para manejar la sobrecarga de líquidos, no se ha demostrado que mejore la supervivencia de los pacientes.
El manejo de la hiperpotasemia y la hiperfosfatemia, dos complicaciones metabólicas comunes en la necrosis tubular aguda, se realiza principalmente mediante la restricción dietética y el uso de agentes quelantes de fosfato que se toman con las comidas. En cuanto a la hipocalcemia, no se recomienda su tratamiento en pacientes con rabdomiolisis, a menos que presenten síntomas clínicos graves. Además, deben evitarse los antiácidos y laxantes que contienen magnesio, ya que el magnesio puede acumularse en estos pacientes, empeorando la disfunción renal.
Es importante ajustar las dosis de todos los medicamentos que son eliminados por los riñones en pacientes con necrosis tubular aguda, dado que la función renal alterada puede prolongar la vida media de estos fármacos y aumentar el riesgo de efectos adversos.
En cuanto a las indicaciones para la diálisis en pacientes con lesión renal aguda debida a necrosis tubular aguda o a otras enfermedades renales intrínsecas, estas incluyen condiciones potencialmente mortales que se conocen por el acrónimo «AEIOUs». Este acrónimo hace referencia a las siguientes indicaciones: alteraciones ácido-base o electrolíticas, como la hiperpotasemia, que no responden al tratamiento médico; intoxicaciones por ciertos fármacos; sobrecarga de volumen que no responde a los diuréticos; y complicaciones urémicas, como encefalopatía, pericarditis y convulsiones. En pacientes críticamente enfermos, incluso anormalidades menos graves pero en progresivo empeoramiento pueden ser indicaciones para el soporte dialítico.
A pesar de las múltiples opciones terapéuticas, es importante señalar que no hay evidencia que sugiera que una terapia renal sustitutiva más intensiva o el inicio más temprano de la diálisis en pacientes con lesión renal aguda proporcione un beneficio en términos de supervivencia. De hecho, el momento óptimo para iniciar la terapia renal sustitutiva sigue siendo un tema de debate, y la decisión debe basarse en la condición clínica del paciente y en las complicaciones asociadas con la insuficiencia renal aguda.
Evolución y pronóstico
El curso clínico de la necrosis tubular aguda se divide comúnmente en tres fases: lesión inicial, fase de mantenimiento y fase de recuperación. Cada una de estas fases refleja diferentes aspectos de la evolución de la enfermedad renal, y su identificación es crucial para el manejo adecuado del paciente.
La fase inicial de lesión ocurre cuando se produce el daño a los túbulos renales debido a factores como la isquemia, la exposición a nefrotoxinas o la inflamación. Durante esta fase, los riñones pueden intentar responder al daño, pero la función renal se ve alterada de manera significativa. A continuación, la fase de mantenimiento sigue a la lesión inicial y se caracteriza por una disminución o alteración continua de la función renal. En esta fase, la producción de orina puede ser insuficiente, lo que da lugar a una condición conocida como oliguría (producción de orina inferior a 500 mL por día). Sin embargo, también existe una forma de necrosis tubular aguda en la que la función renal se conserva en términos de producción urinaria, lo que se denomina necrosis tubular aguda no oligúrica. La necrosis tubular aguda no oligúrica está generalmente asociada con mejores resultados a largo plazo que la forma oligúrica, lo que sugiere que la capacidad de los riñones para mantener una producción urinaria adecuada, aunque aún comprometida, es un indicador favorable para la recuperación. Es importante destacar que la conversión de una condición oligúrica a una no oligúrica mediante el uso de diuréticos no altera el pronóstico de la enfermedad renal. Asimismo, otros agentes que se han pensado que tienen efectos beneficiosos sobre la hemodinámica renal, como la dopamina a baja dosis o el fenoldopam, no han demostrado ser eficaces en numerosos estudios para prevenir la necrosis tubular aguda o acelerar la recuperación de la función renal.
La duración promedio de la fase de mantenimiento varía entre 1 y 3 semanas, aunque en algunos casos puede extenderse por varios meses. Durante este tiempo, los procesos celulares de reparación comienzan a tener lugar, y se inicia la eliminación de los desechos tubulares acumulados, como proteínas y fragmentos celulares. La fase de recuperación puede manifestarse mediante diuresis, que es la producción de grandes volúmenes de orina. Esta diuresis ocurre debido a la incapacidad de los túbulos renales en recuperación para reabsorber de manera adecuada el sodio y el agua. Además, la acumulación de productos como el nitrógeno ureico en sangre (BUN, por sus siglas en inglés) puede inducir una diuresis osmótica, lo que contribuye a un aumento en la cantidad de orina excretada.
A pesar de que la fase de recuperación es un signo positivo de la mejoría renal, es importante reconocer que la mortalidad asociada con la lesión renal aguda en pacientes hospitalizados puede ser considerablemente alta, oscilando entre el 20 y el 50%. En pacientes que requieren diálisis en la unidad de cuidados intensivos, la tasa de mortalidad puede alcanzar hasta el 70%. Factores como la edad avanzada, la presencia de enfermedades subyacentes graves y el fracaso multiorgánico aumentan el riesgo de mortalidad en estos pacientes. Las principales causas de muerte en este contexto incluyen infecciones, alteraciones en los fluidos y electrolitos, y el empeoramiento de las enfermedades subyacentes que inicialmente habían provocado la lesión renal.

Fuente y lecturas recomendadas:
- Campbell RE et al. Overview of antibiotic-induced nephrotoxicity. Kidney Int Rep. 2023;8:2211. [PMID: 38025228]
- Ostermann M et al. Indications for and timing of initiation of KRT. Clin J Am Soc Nephrol. 2023;18:113. [PMID: 36100262]
- Vamireddy L et al. Contrast-associated acute kidney injury: definitions, epidemiology, pathophysiology, and implications. Interv Cardiol Clinic. 2023;12:489. [PMID: 37673493]
- Zarbock A et al. Sepsis-associated acute kidney injury: consensus report of the 28th Acute Disease Quality Initiative workgroup. Nat Rev Nephrol. 2023;19:401. [PMID: 36823168]
Originally posted on 25 de marzo de 2025 @ 6:51 PM