El estudio microscópico de muestras clínicas y de suspensiones de microorganismos constituye una herramienta esencial en microbiología diagnóstica, ya que permite obtener información inmediata sobre la presencia, cantidad y características generales de los agentes infecciosos. La posibilidad de colocar directamente el material biológico sobre un portaobjetos de vidrio y observarlo al microscopio ofrece una aproximación rápida, económica y accesible, especialmente útil en situaciones en las que se requiere una orientación diagnóstica inicial antes de aplicar métodos más complejos.
Este tipo de examen se basa en principios ópticos fundamentales y en la interacción de la luz con las estructuras celulares. Sin embargo, la simplicidad del procedimiento implica limitaciones inherentes que justifican el desarrollo y uso de técnicas complementarias, como la microscopía de contraste de fases y las diversas metodologías de tinción.
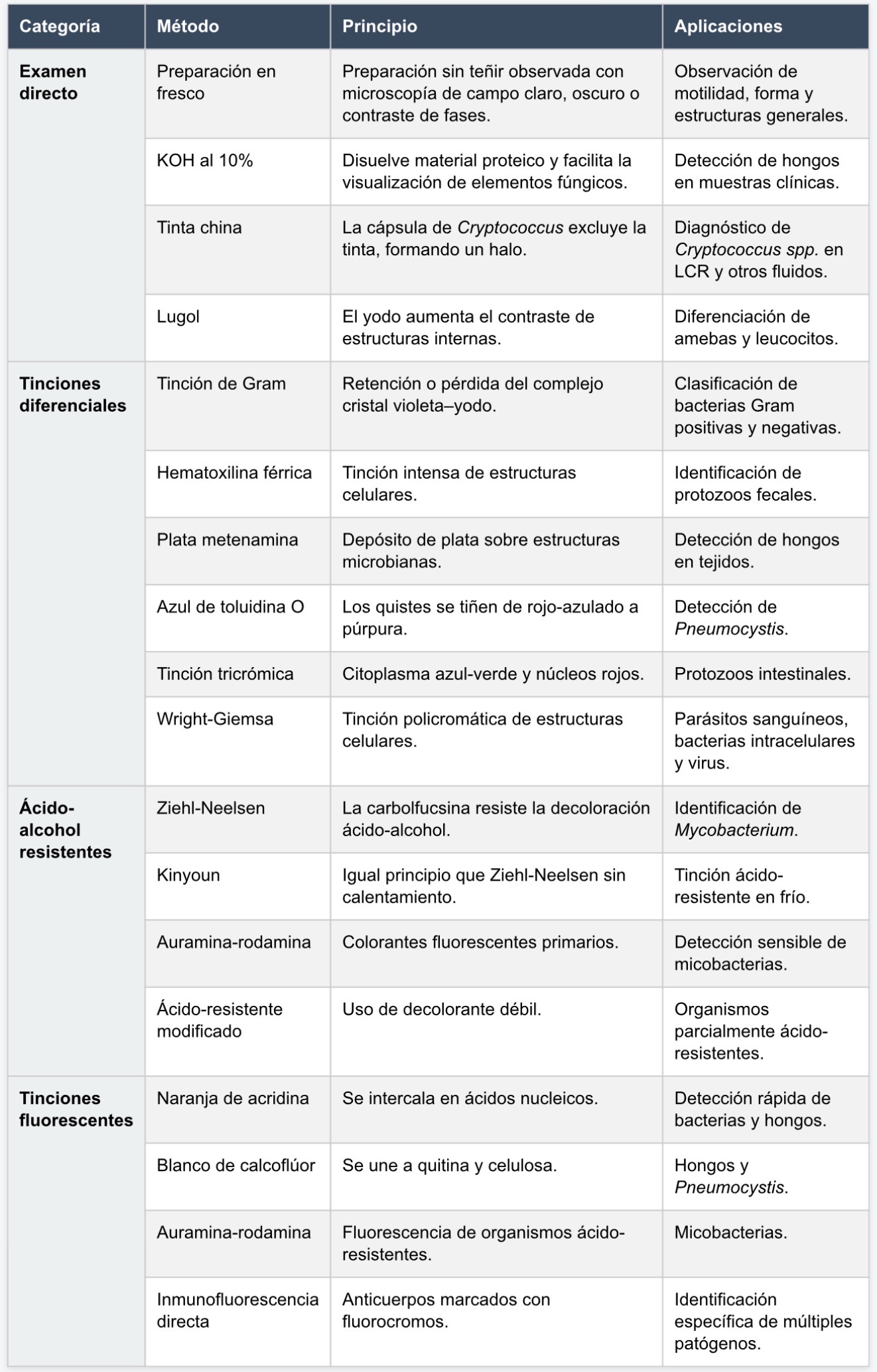
Examen directo en fresco
El examen directo en fresco consiste en la observación de una muestra clínica o de una suspensión microbiana sin fijación ni tinción previa, generalmente suspendida en agua o en una solución salina fisiológica. Este procedimiento permite evaluar el material en un estado cercano al natural, conservando la morfología global y, en algunos casos, la motilidad de los organismos.
Gracias a este método, es posible detectar con relativa facilidad organismos de gran tamaño, como estructuras fúngicas, helmintos, protozoos y abundante material celular del hospedador. Estas formas biológicas presentan dimensiones y configuraciones suficientemente contrastantes como para ser visibles aun sin tratamiento adicional. No obstante, la observación detallada de la organización interna de las células suele ser dificultosa, ya que los componentes celulares presentan índices de refracción similares al medio acuoso que los rodea, lo que reduce el contraste y hace que los límites estructurales sean poco definidos.
La principal dificultad del examen directo radica en la escasa diferenciación entre las estructuras celulares y el fondo. En ausencia de colorantes, la luz atraviesa las células sin generar variaciones significativas de intensidad, lo que impide distinguir con claridad organelos, paredes celulares o inclusiones citoplasmáticas. Esta limitación explica por qué el examen directo, aunque útil para la detección inicial, resulta insuficiente para un análisis morfológico profundo o para la identificación precisa de muchos microorganismos.
La microscopía de contraste de fases surge como una alternativa para superar parcialmente estas limitaciones, ya que transforma pequeñas diferencias en la velocidad de propagación de la luz, causadas por variaciones en la densidad celular, en contrastes visibles. Aun así, esta técnica no sustituye completamente a los métodos de tinción, que proporcionan una diferenciación mucho más marcada y específica.
Métodos de examen directo modificados
Suspensiones con agentes alcalinos
Una estrategia para mejorar la visualización consiste en tratar la muestra con sustancias alcalinas, como el hidróxido de potasio. Este compuesto disuelve el material de fondo rico en proteínas, lípidos o queratina, que suele interferir con la observación, mientras preserva estructuras más resistentes, como las paredes celulares de los hongos. De este modo, se logra un campo microscópico más limpio, en el que las estructuras de interés destacan con mayor claridad.
Uso de colorantes de contraste
Otra variante del examen directo implica la adición de colorantes que tiñen de manera inespecífica los componentes celulares. Sustancias como el lactofenol con azul de algodón o el yodo se unen a estructuras celulares diversas, aumentando el contraste entre el microorganismo y el entorno. Aunque estos colorantes no discriminan tipos celulares específicos, facilitan la observación de detalles morfológicos relevantes, como hifas, esporas o quistes.
Estos métodos resultan especialmente útiles para la detección rápida y la identificación presuntiva de hongos y parásitos, cuyo reconocimiento suele basarse en patrones estructurales característicos.
Tinción de fondo negativo
Una aproximación conceptualmente distinta es el uso de colorantes que no tiñen la célula, sino el fondo que la rodea. En el método de la tinta china, las partículas del colorante oscurecen el entorno, mientras que ciertas estructuras celulares, como las cápsulas, excluyen el tinte. Este fenómeno genera un halo claro alrededor del microorganismo, lo que permite identificar cápsulas polisacáridas con gran facilidad.
Este principio es particularmente valioso para la detección de levaduras encapsuladas del género Cryptococcus y de bacterias encapsuladas como Bacillus anthracis, en las que la cápsula constituye un importante factor de virulencia y un rasgo diagnóstico distintivo.
Tinciones diferenciales
Las tinciones diferenciales se diseñan para resaltar diferencias específicas en la composición química o estructural de los microorganismos. La tinción de Gram es el ejemplo más representativo y ampliamente utilizado, ya que clasifica a las bacterias en dos grandes grupos según la estructura de su pared celular. Este método no solo orienta la identificación, sino que también tiene implicaciones clínicas y terapéuticas.
Además de las bacterias, las levaduras y los mohos reaccionan positivamente a esta tinción, lo que permite su observación en muestras clínicas. Otras tinciones diferenciales, como la hematoxilina férrica y la tricrómica, son fundamentales para el estudio de protozoos intestinales, ya que permiten distinguir núcleos, citoplasma y estructuras internas con gran precisión. La tinción de Wright-Giemsa, por su parte, es esencial para la identificación de parásitos sanguíneos y de ciertos microorganismos intracelulares.
Con el avance de la tecnología, algunas tinciones clásicas han sido desplazadas por métodos más sensibles o técnicamente más simples, lo que refleja la evolución constante de las técnicas diagnósticas.
Tinciones ácido resistentes
Las tinciones ácido resistentes se basan en la capacidad de ciertos microorganismos de retener un colorante primario incluso después de ser expuestos a agentes decolorantes intensos. Esta propiedad está relacionada con la presencia de lípidos complejos en la pared celular, que confieren una resistencia particular a la decoloración.
El método de Ziehl-Neelsen es la técnica histórica más conocida, aunque requiere calentamiento del preparado para facilitar la penetración del colorante. En la práctica moderna, este procedimiento ha sido reemplazado en muchos laboratorios por métodos en frío o por técnicas que utilizan colorantes fluorescentes, debido a su mayor eficiencia y facilidad de interpretación.
Algunos microorganismos presentan una resistencia parcial a la decoloración, característica poco común que resulta extremadamente útil como criterio preliminar de identificación, ya que restringe el diagnóstico a un grupo muy limitado de agentes.
Tinciones fluorescentes
Las tinciones fluorescentes representan una de las herramientas más sensibles del diagnóstico microscópico. En estas técnicas, los colorantes emiten luz cuando son excitados por una longitud de onda específica, lo que permite observar los microorganismos como estructuras brillantes sobre un fondo oscuro.
El uso de colorantes fluorescentes se ha extendido a múltiples aplicaciones. Algunos se unen a los ácidos nucleicos, permitiendo la visualización general de bacterias y hongos, mientras que otros se fijan a componentes estructurales específicos, como la quitina de las paredes celulares fúngicas. Estas técnicas han sustituido en gran medida a métodos más simples, debido a su mayor sensibilidad y rapidez.
Un avance adicional es el empleo de anticuerpos marcados con fluorocromos, que reconocen de manera altamente específica antígenos microbianos. La detección de fluorescencia en este contexto no solo confirma la presencia del microorganismo, sino que también permite su identificación directa, consolidando estas técnicas como herramientas clave en el diagnóstico microbiológico moderno.
Preparaciones microscópicas y tinciones en Microbiología Clínica

Fuente y lecturas recomendadas:
- Madigan, M. T., Martinko, J. M., Bender, K. S., Buckley, D. H., & Stahl, D. A. (2018). Brock biology of microorganisms (15th ed.). Pearson.
- Murray, P. R., Rosenthal, K. S., & Pfaller, M. A. (2025). Medical microbiology (10th ed.). Elsevier.
- Postgate, J. (2000). Microbes and man (4th ed.). Cambridge University Press.
- Riedel, S., Hobden, J. A., Miller, S., Morse, S. A., Mietzner, T. A., Detrick, B., Mitchell, T. G., Sakanari, J. A., Hotez, P., & Mejía, R. (2020). Microbiología médica (28ª ed.). McGraw-Hill Interamericana Editores.





