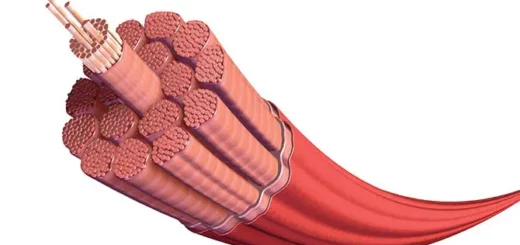
Características de las fibras de colágeno
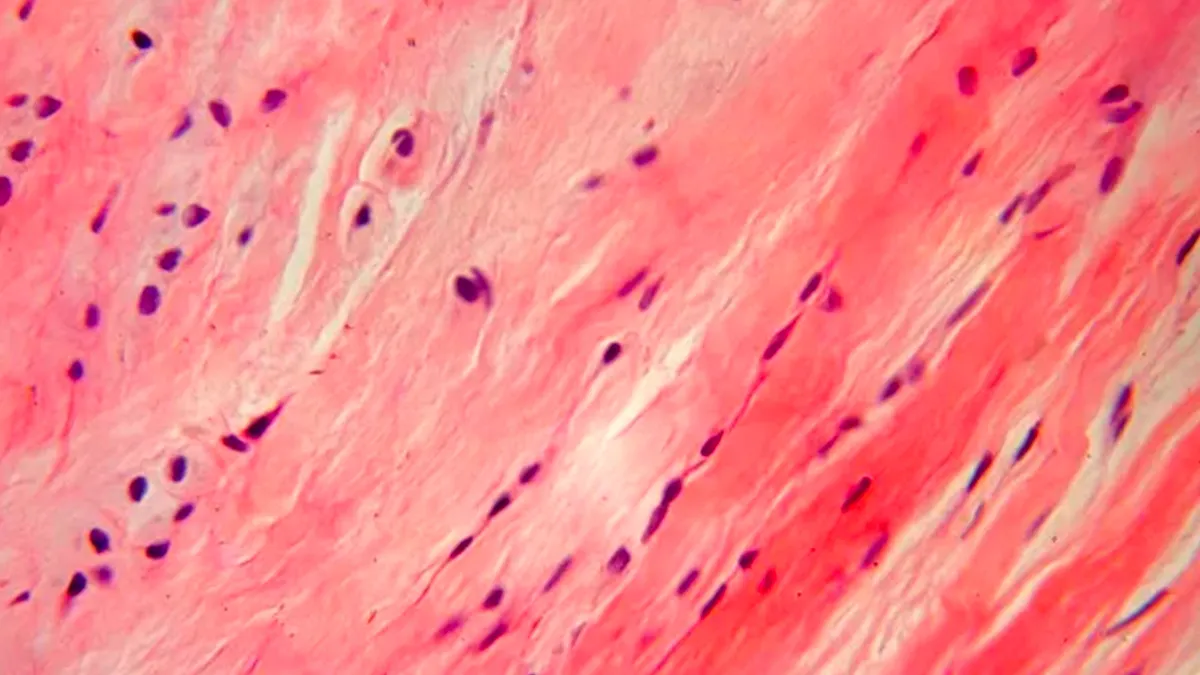
Las fibras del tejido conjuntivo están presentes en distintas cantidades, según las necesidades estructurales o la función del tejido conjuntivo. Cada tipo de fibra es producida por los fibroblastos y se compone de proteínas de cadenas peptídicas largas. Se dividen en tres clases principales.
- Fibras de colágeno
- Fibras reticulares
- Fibras elásticas
Las fibras de colágeno son el componente estructural más abundante del tejido conjuntivo. Son flexibles y tienen una resistencia tensora notable. Bajo el microscopio óptico, normalmente las fibras de colágeno aparecen como estructuras onduladas de espesor variable y longitud indeterminada. Se tiñen fácilmente con eosina y otros colorantes ácidos.
Con la microscopía electrónica de transmisión (MET), las fibras de colágeno aparecen como haces de subunidades filamentosas finas. Estas subunidades son fibrillas de colágeno. Dentro de cada fibra, las fibrillas de colágeno tienen un diámetro relativamente uniforme. Sin embargo, en distintos sitios y en distintas etapas de desarrollo, las fibrillas varían en tamaño. En los tejidos en desarrollo o inmaduros, las fibrillas pueden tener no más de 15 nm o 20 nm de diámetro. En el tejido conjuntivo denso regular que se encuentra en los tendones y en otros tejidos sujetos a una tensión considerable, pueden medir hasta 300 nm de diámetro.
Cuando las fibrillas de colágeno teñidas con osmio u otro metal pesado se examinan con el microscopio electrónico de transmisión, muestran una secuencia de bandas transversales espaciadas regularmente y que se repiten cada 68 nm en toda su longitud. El patrón
de bandas es un reflejo de la estructura en subunidades de la fibrilla, específicamente del tamaño y la forma de la molécula de colágeno y la disposición de las moléculas que forman la fibrilla.
La molécula de colágeno mide unos 300 nm de largo por 1,5 nm de espesor y tiene una cabeza y una cola. Dentro de cada fibrilla, las moléculas de colágeno se alinean cabeza con cola en hileras superpuestas con brechas entre las moléculas de cada hilera y un desfase de un cuarto de molécula entre las hileras contiguas. El patrón de bandas transversales se debe en gran medida al depósito de osmio en el espacio que hay entre las cabezas y las colas de las moléculas encada hilera.
La resistencia a la tensión de la fibrilla es consecuencia de los enlaces covalentes que hay entre las moléculas de colágeno de hileras contiguas y no de las uniones cabeza con cola entre las moléculas de una hilera.
Cada molécula de colágeno consiste en tres cadenas polipeptídicas llamadas cadenas α. Las cadenas a se entrelazan para formar una hélice triple dextrógira. De cada tres aminoácidos de la cadena, uno es una molécula de glicina, excepto en los extremos de las cadenas α. Una hidroxiprolina o una hidroxilisina suele preceder a cada glicina en la cadena; y una prolina con frecuencia sigue a cada glicina de
la cadena. Junto con la prolina y la hidroxiprolina, la glicina es indispensable para la conformación en hélice triple
En asociación con la hélice, hay también grupos sacáridosunidos a los residuos hidroxilisílicos. Es por estos grupos sacáridos que el colágeno se clasifica propiamente como una glucoproteína.
Las cadenas a que conforman la hélice no son todas iguales pues su tamaño varía entre 600 y 3,000 aminoácidos. Hasta ahora, se han identificado al menos 42 tipos de cadenas a codificadas por diferentes genes cuyos loci se encuentran de distintos cromosomas. Se han categorizado unos 29 tipos de colágeno teniendo en cuenta las combinaciones de las cadenas a que contienen. Los colágenos se clasifican con números romanos del I al XXIX según su fecha de descubrimiento.
Una molécula de colágeno puede ser homotrimérica (compuesta por tres cadenas a idénticas) o heterotrimérica (formada por dos o hasta tres cadenas a diferentes).
- El colágeno tipo I, que se encuentra en los tejidos conjuntivos denso y laxo es heterotrimérico. Dos de las cadenas a, identificadas como α1, son idénticas, y una, identificada como α2, es diferente.
- El colágeno tipo II es homotrimérico y está presente en la hialina y en el cartílago elástico, donde aparece en forma de fibrillas muy
delgadas. Las moléculas de colágeno de tipo II están compuestas por tres cadenas a idénticas.
Según su patrón de polimerización, se pueden identificar varias clases de colágeno. La mayoría de las moléculas de colágeno se polimerizan en agregados supramoleculares, como fibrillas o redes, y se dividen en distintos subgrupos según sus semejanzas estructurales o según la secuencia de aminoácidos.
- Los colágenos fibrilares incluyen las moléculas de colágeno tipos I, II, III, V, y XI. Estos tipos se caracterizan por presentar repeticiones ininterrumpidas de glicina-prolina-hidroxiprolina y se aglomeran para formar fibrillas con bandas de 68 nm.
- Los colágenos asociados con fibrillas con hélices triples interrumpidas exhiben interrupciones en sus hélices triples que le aportan flexibilidad a la molécula. Se encuentran en la superficie de las distintas fibrillas y están representados por los colágenos de tipos IX, XII, XIV, XVI, XIX, XX, XXI, y XXII.
- Los colágenos formadores de redes hexagonales están representados por los colágenos tipos VIII y X.
- Los colágenos transmembrana son los tipos XIII (que se hallan en las adhesiones focales), XVII (que se encuentran en los hemidesmosomas), XXIII (que aparecen en las células cancerígenas metastásicas) y XXV (un tipo de colágeno específico del encéfalo).
- Las multiplexinas (colágenos con dominios en hélice triple e interrupciones múltiples) comprenden los colágenos de tipos XV y XVIII, que se hallan en las zonas de la membrana basal.
- Los colágenos formadores de la membrana basal incluyen el colágeno tipo IV, que es el responsable de la supraestructura de colágeno en la membrana basal de las células epiteliales; el colágeno tipo VI, que forma los filamentos perlados y el colágeno tipo VII, que forma las fibrillas de anclaje que fijan la membrana basal a la matriz extracelular.
 Síguenos en X: @el_homomedicus y @enarm_intensivo
APRENDER CIRUGÍA
Síguenos en X: @el_homomedicus y @enarm_intensivo
APRENDER CIRUGÍA