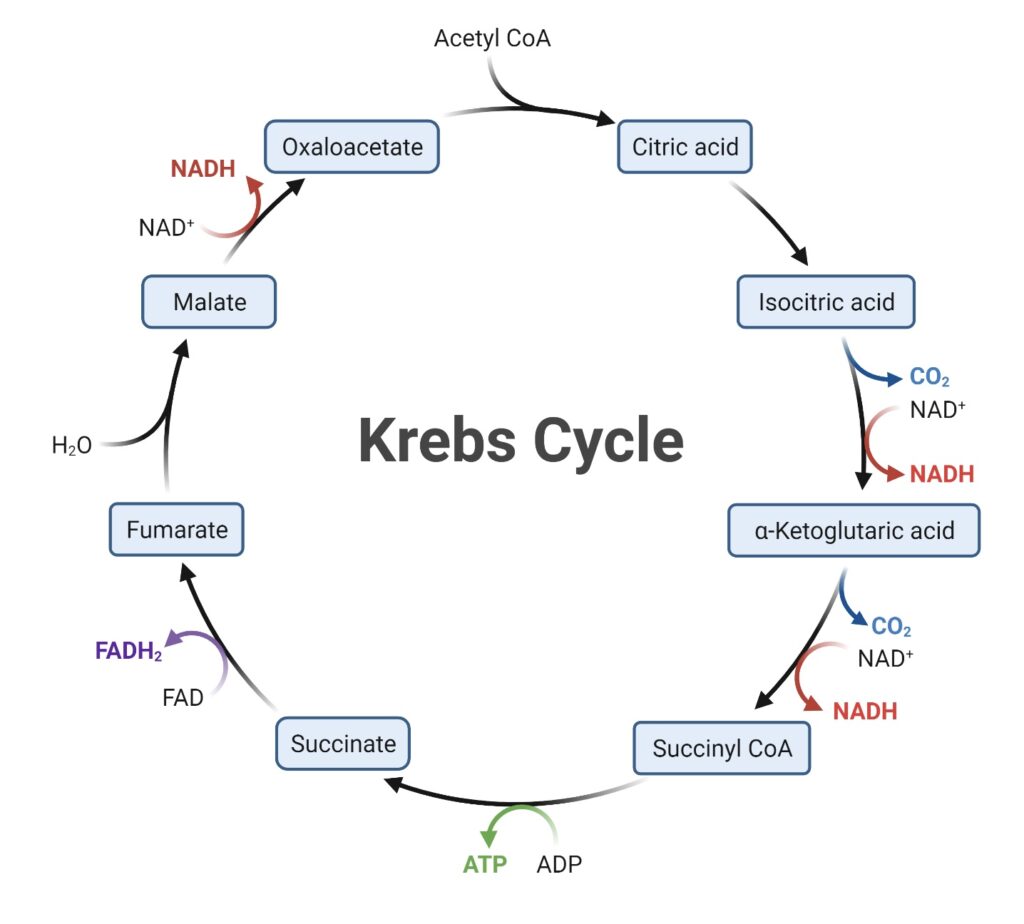
El ciclo del ácido cítrico, también conocido como ciclo de Krebs o ciclo del ácido tricarboxílico, constituye la ruta central del metabolismo energético celular y se desarrolla en la matriz mitocondrial. Esta vía bioquímica desempeña un papel esencial como punto de convergencia y de interconexión entre el catabolismo de los carbohidratos, los lípidos y los aminoácidos, permitiendo la integración de los procesos metabólicos en una red coordinada de obtención y aprovechamiento de energía.
La razón de su carácter central reside en que los productos de degradación de los principales nutrientes —glucosa, ácidos grasos y aminoácidos— se transforman finalmente en una misma molécula: la acetil coenzima A (acetil-CoA). Este compuesto representa el punto de entrada común al ciclo del ácido cítrico. En este proceso, el grupo acetilo de dos carbonos procedente de la acetil-CoA se condensa con el oxaloacetato para formar citrato, una molécula de seis carbonos que inicia la secuencia de reacciones cíclicas. A través de una serie ordenada de transformaciones químicas, el residuo acetilo se oxida completamente hasta dióxido de carbono, y la energía liberada en estas oxidaciones se conserva en forma de equivalentes reducidos, principalmente NADH y FADH₂, que posteriormente alimentan la cadena transportadora de electrones para la síntesis de trifosfato de adenosina (ATP).
Además de su función oxidativa, el ciclo del ácido cítrico actúa como un punto nodal en el metabolismo intermediario. Varios de sus compuestos sirven como precursores para rutas biosintéticas esenciales. Por ejemplo, el citrato puede ser transportado al citoplasma y actuar como fuente de carbono para la síntesis de ácidos grasos (lipogénesis), mientras que el oxaloacetato y el α-cetoglutarato participan en la síntesis y en la interconversión de aminoácidos. Asimismo, el oxaloacetato puede ser utilizado como sustrato en la gluconeogénesis, contribuyendo a la generación de glucosa a partir de compuestos no carbohidratados.
Una característica notable del ciclo es que solo se requiere una cantidad mínima de oxaloacetato para la oxidación de grandes cantidades de acetil-CoA, debido a que este intermediario se regenera al final de cada vuelta del ciclo, desempeñando un papel catalítico. Este carácter regenerativo garantiza la continuidad del proceso y mantiene el flujo metabólico hacia la producción de energía.
Cofactores
Las enzimas son biomoléculas de naturaleza proteica cuya función principal es actuar como catalizadores biológicos, es decir, acelerar la velocidad de las reacciones químicas que tienen lugar en los organismos vivos sin ser consumidas en el proceso. Su acción es fundamental para mantener la vida, pues permite que las reacciones metabólicas ocurran con la rapidez y eficiencia necesarias bajo las condiciones fisiológicas del cuerpo, que suelen ser suaves en comparación con las condiciones extremas requeridas por reacciones químicas no catalizadas. Sin embargo, la actividad de muchas enzimas depende de la presencia de moléculas o iones complementarios denominados cofactores, que son esenciales para que la enzima adquiera su conformación activa o para que participe adecuadamente en el intercambio de electrones, protones o grupos funcionales durante la catálisis.
Los cofactores pueden clasificarse en dos grandes categorías: los inorgánicos, que suelen ser iones metálicos, y los orgánicos, conocidos como coenzimas. Los iones metálicos, tales como el magnesio, el hierro o el manganeso, actúan estabilizando cargas negativas, facilitando la unión del sustrato al sitio activo o participando directamente en las transferencias electrónicas que ocurren durante la reacción. Por otro lado, las coenzimas son moléculas orgánicas no proteicas que colaboran estrechamente con la enzima, actuando en muchos casos como transportadores transitorios de átomos o de grupos químicos. A diferencia de los iones metálicos, las coenzimas suelen derivarse de vitaminas, y muchas de ellas desempeñan papeles indispensables en los procesos de oxidación y reducción que sustentan el metabolismo energético.
Entre las coenzimas más relevantes se encuentran la nicotinamida adenina dinucleótido (NAD⁺) y la flavina adenina dinucleótido (FAD). Ambas funcionan como transportadores de electrones en reacciones de óxido-reducción. La molécula de NAD⁺ tiene la capacidad de aceptar un par de electrones y un protón, transformándose en su forma reducida, NADH. De manera análoga, el FAD acepta dos electrones y dos protones para generar FADH₂. Estas formas reducidas representan portadores energéticos, ya que contienen electrones de alta energía que pueden ser transferidos a la cadena transportadora de electrones localizada en la membrana interna de la mitocondria. Durante este proceso, NADH y FADH₂ se reoxidan, liberando la energía necesaria para la síntesis de trifosfato de adenosina (ATP) a través de la fosforilación oxidativa. Este mecanismo constituye la etapa final y más eficiente de la producción de energía en la célula.
La estrecha relación entre coenzimas y vitaminas resalta la importancia de estos micronutrientes en la bioenergética celular. Varias vitaminas del complejo B desempeñan papeles esenciales como precursores de coenzimas indispensables en el ciclo del ácido cítrico y en otros procesos metabólicos. La riboflavina, por ejemplo, origina el FAD, que actúa como cofactor en la enzima succinato deshidrogenasa. La niacina es precursora del NAD⁺, fundamental en reacciones catalizadas por las enzimas isocitrato deshidrogenasa, alfacetoglutarato deshidrogenasa y malato deshidrogenasa. La tiamina, en su forma de difosfato de tiamina, participa en la descarboxilación catalizada por la alfacetoglutarato deshidrogenasa. Finalmente, el ácido pantoténico forma parte de la coenzima A, molécula clave en la activación y el transporte de grupos acilo, dando origen a intermediarios metabólicos como la acetil coenzima A y la succinil coenzima A.
Etapas del ciclo de Krebs
Por cada molécula de acetil coenzima A que ingresa al ciclo del ácido cítrico, la célula obtiene una notable cantidad de energía química en forma de moléculas reducidas y de trifosfato de adenosina o guanosina. Este proceso constituye uno de los pilares del metabolismo energético, ya que convierte la energía potencial contenida en los enlaces químicos del acetil-CoA en una forma de energía utilizable por la célula. Durante una vuelta completa del ciclo, se generan tres moléculas de nicotinamida adenina dinucleótido reducida (NADH), una molécula de flavina adenina dinucleótido reducida (FADH₂), una molécula de guanosina trifosfato o adenosina trifosfato (GTP o ATP, según el tipo de célula) y dos moléculas de dióxido de carbono, que son liberadas como producto final de la oxidación completa del grupo acetilo.
La energía no se obtiene de manera directa del ciclo, sino de las coenzimas reducidas que en él se producen. Tanto el NADH como el FADH₂ actúan como portadores de electrones de alta energía que son transferidos posteriormente a la cadena de transporte de electrones localizada en la membrana interna de la mitocondria. Durante este proceso de reoxidación, los electrones se desplazan a través de una serie de complejos proteicos que aprovechan la energía liberada para bombear protones hacia el espacio intermembrana. Este gradiente electroquímico de protones constituye la fuerza motriz que impulsa la síntesis de trifosfato de adenosina mediante el proceso denominado fosforilación oxidativa. En conjunto, los tres NADH y el FADH₂ generados en el ciclo del ácido cítrico permiten la producción aproximada de diez moléculas de trifosfato de adenosina por cada molécula de acetil-CoA oxidada, de las cuales nueve derivan de la reoxidación de las coenzimas y una proviene directamente del ciclo.
- El ciclo del ácido cítrico se inicia con una reacción fundamental que marca la entrada del grupo acetilo en la secuencia de transformaciones energéticas de la mitocondria. Esta reacción inicial consiste en la condensación del oxaloacetato, un compuesto de cuatro carbonos, con la molécula de acetil coenzima A, que aporta dos carbonos. El proceso está catalizado por la enzima citrato sintasa, la cual desempeña una función esencial en la formación del citrato, una molécula de seis carbonos. Durante la reacción, la citrato sintasa promueve la creación de un nuevo enlace carbono-carbono entre el carbono metílico del grupo acetilo y el carbono carbonílico del oxaloacetato. El producto intermedio, denominado citril-CoA, contiene un enlace de tipo tioéster altamente inestable. La hidrólisis de este enlace libera la molécula de citrato y la coenzima A libre (CoASH), en una reacción exotérmica que impulsa la dirección espontánea del proceso.
- Una vez formado el citrato, este se somete a una transformación estructural que reorganiza su configuración para permitir las reacciones de oxidación posteriores. La enzima responsable de esta conversión es la aconitasa, también conocida como aconitato hidratasa, la cual cataliza una isomerización en dos pasos. Primero, el citrato se deshidrata parcialmente para producir un intermediario llamado cis-aconitato, y luego se rehidrata de manera estereoespecífica para generar isocitrato. Esta modificación no altera el número de carbonos de la molécula, pero cambia la posición del grupo hidroxilo, preparándola para las siguientes etapas de oxidación y descarboxilación.
- El isocitrato, ya en una posición adecuada para su oxidación, es sometido a una reacción catalizada por la isocitrato deshidrogenasa, una enzima clave del ciclo. Esta reacción ocurre en dos fases: en la primera, el isocitrato se oxida para formar oxalosuccinato, un intermediario inestable que permanece unido al sitio activo de la enzima; en la segunda, el oxalosuccinato se descarboxila, liberando dióxido de carbono y formando α-cetoglutarato. Durante esta transformación, la nicotinamida adenina dinucleótido (NAD⁺) actúa como aceptor de electrones, reduciéndose a NADH. Para que la enzima funcione correctamente, se requiere la presencia de iones de magnesio o manganeso, los cuales estabilizan las cargas negativas generadas durante la reacción.
- El siguiente paso del ciclo implica otra descarboxilación oxidativa, esta vez del α-cetoglutarato, que da origen a succinil-CoA. Esta reacción es catalizada por el complejo multienzimático α-cetoglutarato deshidrogenasa, uno de los más sofisticados del metabolismo celular. Dicho complejo utiliza múltiples cofactores —difosfato de tiamina, ácido lipoico, nicotinamida adenina dinucleótido (NAD⁺), flavina adenina dinucleótido (FAD) y coenzima A— y funciona de manera similar al complejo piruvato deshidrogenasa. El resultado final es la formación de succinil-CoA, una molécula rica en energía, acompañada de la liberación de otra molécula de dióxido de carbono y de un NADH adicional.
- A continuación, la succinil-CoA se convierte en succinato mediante la enzima succinil-CoA sintetasa, también llamada succinato tiocinasa. En esta reacción, la energía liberada por la ruptura del enlace tioéster de la succinil-CoA se aprovecha para fosforilar directamente una molécula de GDP o ADP, dando lugar a guanosina trifosfato o adenosina trifosfato (GTP o ATP). Este paso representa el único punto del ciclo en el que se produce energía en forma de trifosfato sin intervención de la cadena respiratoria. Cabe destacar que en los tejidos donde ocurre la gluconeogénesis, como el hígado y el riñón, existen dos isoformas de esta enzima: una que utiliza GDP y otra que emplea ADP como sustrato. Los tejidos no gluconeogénicos, en cambio, solo poseen la isoforma dependiente del ADP.
- En condiciones metabólicas específicas, como durante la utilización de cuerpos cetónicos en tejidos extrahepáticos, la succinil-CoA también participa en una reacción catalizada por la enzima succinil-CoA-acetoacetato-CoA transferasa, o tioforasa. En este proceso, el grupo CoA se transfiere desde la succinil-CoA al acetoacetato, generando acetoacetil-CoA y succinato. Esta vía alternativa ilustra la versatilidad del ciclo en la interconexión de diferentes rutas metabólicas.
- Posteriormente, el succinato se oxida a fumarato mediante la enzima succinato deshidrogenasa, que se distingue del resto de las enzimas del ciclo por encontrarse unida a la membrana interna mitocondrial, en estrecha asociación con la cadena transportadora de electrones. Durante esta reacción, el flavina adenina dinucleótido (FAD) se reduce a FADH₂, permitiendo la transferencia de electrones hacia los complejos respiratorios.
- El fumarato resultante es hidratado por la fumarasa (también llamada fumarato hidratasa) para formar malato, en una reacción reversible que adiciona una molécula de agua al doble enlace del fumarato. Finalmente, el malato se oxida a oxaloacetato por acción de la malato deshidrogenasa, cerrando el ciclo. Esta última reacción está acoplada a la reducción de NAD⁺ a NADH, proporcionando más equivalentes reducidos para la producción de energía a través de la fosforilación oxidativa.
Oxidación: es el proceso en el que una molécula, átomo o ion pierde electrones. Al perder electrones, generalmente gana oxígeno o pierde hidrógeno.
Reducción: es el proceso en el que una molécula, átomo o ion gana electrones. Al ganar electrones, generalmente pierde oxígeno o gana hidrógeno.
Por combinar funciones catabólicas (oxidación de moléculas para obtener energía) y anabólicas (provisión de precursores para síntesis), el ciclo se considera anfibólico.
Anfibólico: término que se usa en bioquímica para describir vías metabólicas que cumplen tanto funciones catabólicas como anabólicas.
- Catabólica: descomponen moléculas para liberar energía.
- Anabólica: usan intermediarios para sintetizar compuestos necesarios (como aminoácidos, glucosa o ácidos grasos).
Productos
Durante el desarrollo del ciclo del ácido cítrico, varias enzimas específicas conocidas como deshidrogenasas cumplen un papel fundamental al catalizar reacciones de oxidación, en las cuales los sustratos metabólicos pierden electrones. Estas reacciones son esenciales porque permiten la captura de energía química contenida en los enlaces de las moléculas que se van transformando, transfiriéndola a transportadores electrónicos de alta energía. Por cada molécula de acetil coenzima A que ingresa al ciclo, las deshidrogenasas generan aproximadamente tres moléculas de nicotinamida adenina dinucleótido reducido y una molécula de flavina adenina dinucleótido reducido, denominadas NADH y FADH₂, respectivamente. Estas coenzimas reducidas actúan como vehículos que transportan los electrones hacia la cadena de transporte de electrones ubicada en la membrana interna de la mitocondria. Allí, la liberación controlada de electrones permite la generación de un gradiente de protones que finalmente se utiliza para la síntesis de trifosfato de adenosina. En términos cuantitativos, cada NADH aporta aproximadamente dos punto cinco moléculas de ATP y cada FADH₂ alrededor de una punto cinco moléculas de ATP.
Además de la producción de energía a través de estas coenzimas, el ciclo del ácido cítrico genera directamente una molécula de trifosfato de guanosina o trifosfato de adenosina mediante un mecanismo denominado fosforilación a nivel de sustrato. Esta reacción es catalizada por la enzima succinil-CoA sintetasa, que transfiere un grupo fosfato inorgánico desde el succinil-CoA al nucleótido diphosfato correspondiente, formando así GTP o ATP. De esta manera, cada molécula de acetil-CoA que atraviesa el ciclo puede contribuir con aproximadamente diez moléculas de trifosfato de adenosina en total, combinando la energía almacenada en NADH y FADH₂ con la producción directa de ATP en el ciclo.
Más allá de su papel catabólico, el ciclo del ácido cítrico funciona como un nodo central en la red metabólica de la célula. Sus intermediarios no solo participan en la oxidación de acetil-CoA, sino que también sirven como precursores para diversas rutas anabólicas. Por ejemplo, ciertos intermediarios pueden entrar en rutas de transaminación y desaminación, facilitando la síntesis y la degradación de aminoácidos, así como la interconversión de metabolitos. Otros intermediarios contribuyen a la gluconeogénesis, la formación de ácidos grasos y la producción de compuestos nitrogenados, demostrando la versatilidad del ciclo como centro metabólico. En particular, todos los intermediarios del ciclo son potencialmente glucogénicos, dado que pueden derivar en oxaloacetato, el cual constituye un punto de partida para la síntesis de glucosa en hígado y riñones. La enzima fosfoenolpiruvato carboxicinasa desempeña un papel clave en esta transición, catalizando la conversión de oxaloacetato a fosfoenolpiruvato con participación del GTP como donador de fosfato.
La velocidad y la actividad del ciclo del ácido cítrico no son constantes, sino que se ajustan de acuerdo con la demanda energética de la célula. La disponibilidad de cofactores oxidados, como NAD⁺ y FAD, es determinante, ya que estas moléculas deben aceptar electrones durante las oxidaciones. Una deficiencia en estos cofactores limita la progresión del ciclo y reduce la eficiencia de la producción de energía. Asimismo, el ciclo está estrechamente acoplado a la cadena de transporte de electrones y a la fosforilación oxidativa; en la mayoría de los tejidos, su función principal es suministrar energía en forma de ATP, de manera que la actividad del ciclo se integra dinámicamente con las necesidades metabólicas de la célula.

Fuente y lecturas recomendadas:
- Kennelly, P. J., Botham, K. M., McGuinness, O. P., Rodwell, V. W., & Weil, P. A. (2023). Harper. Bioquímica ilustrada (32.ª ed.). McGraw Hill.
- Nelson, D. L., & Cox, M. M. (2017). Lehninger principles of biochemistry (7th ed.). W. H. Freeman.
- Berg, J. M., Tymoczko, J. L., & Stryer, L. (2013). Bioquímica (7.ª ed.). Editorial Reverté.
- McKee, T., & McKee, J. R. (2020). Bioquímica: Las bases moleculares de la vida (7.ª ed.). McGraw-Hill.