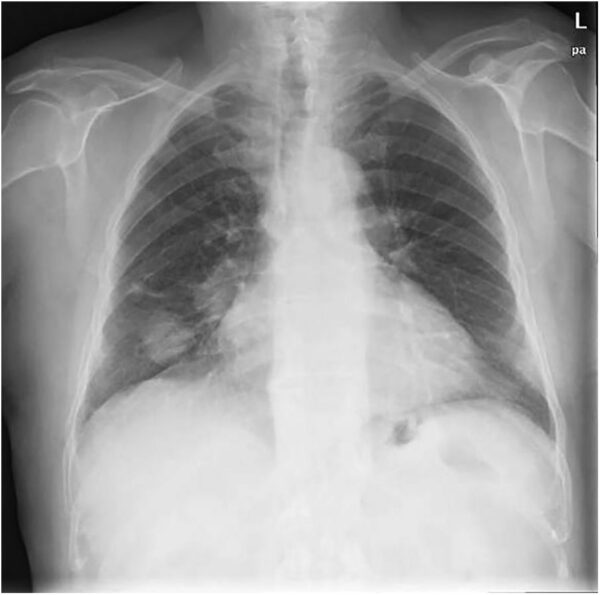
El cáncer de pulmón constituye actualmente la primera causa de mortalidad oncológica a nivel mundial tanto en varones como en mujeres, fenómeno que obedece a una confluencia de factores biológicos, ambientales y conductuales. Su alta letalidad se explica no solo por su elevada incidencia, sino también por el diagnóstico frecuente en estadios avanzados, la agresividad biológica de muchas de sus variantes y las limitaciones terapéuticas en etapas metastásicas.
Una de las causas primordiales de este tipo de neoplasia es la exposición prolongada y repetida a sustancias carcinógenas inhaladas, siendo el consumo activo de productos derivados del tabaco el principal responsable. Se estima que entre el ochenta y cinco y el noventa por ciento de los casos de cáncer pulmonar están directamente relacionados con el hábito de fumar cigarrillos. El humo del tabaco contiene una mezcla compleja de más de siete mil compuestos químicos, de los cuales al menos setenta han sido identificados como cancerígenos. Estas sustancias generan mutaciones en el ADN de las células epiteliales del tracto respiratorio, alterando mecanismos de regulación del ciclo celular, reparación genética y apoptosis, lo cual favorece la transformación maligna.
No obstante, el riesgo no se limita al fumador activo. La exposición pasiva al humo ambiental del tabaco —también conocido como humo de segunda mano— representa un peligro significativo, especialmente en entornos cerrados. A ello se suman otros agentes inhalatorios de origen ambiental u ocupacional que, al acumularse en el tejido pulmonar, contribuyen al proceso de carcinogénesis. Entre ellos se destacan el gas radón —un producto de la desintegración del uranio presente en suelos y rocas—, fibras de asbesto, partículas de diésel, compuestos metálicos como el arsénico, el cromo, el níquel, el óxido de hierro, y diversas sustancias empleadas en industrias químicas. Todos estos factores actúan como iniciadores o promotores de daño genómico en las células del epitelio bronquial.
A nivel individual, también se ha reconocido una susceptibilidad genética que aumenta la probabilidad de desarrollar cáncer de pulmón. Esta predisposición hereditaria puede manifestarse como mutaciones germinales en genes supresores de tumores o en genes relacionados con la detoxificación de compuestos tóxicos inhalados, lo que sugiere una interacción compleja entre factores ambientales y genéticos.
En cuanto a la comorbilidad, ciertas enfermedades pulmonares crónicas contribuyen a un microambiente inflamatorio persistente que favorece el desarrollo de tumores. Tal es el caso de la fibrosis pulmonar idiopática, la enfermedad pulmonar obstructiva crónica y la sarcoidosis. En estas condiciones, la reparación celular repetitiva y la presencia de estrés oxidativo crónico pueden inducir alteraciones moleculares que desembocan en la malignización celular.
La edad también juega un papel significativo en la epidemiología del cáncer de pulmón. La mediana de edad al momento del diagnóstico es de setenta y un años, lo que refleja la acumulación progresiva de mutaciones genéticas con el envejecimiento y la exposición prolongada a factores de riesgo. Es inusual que esta enfermedad se presente antes de los cuarenta años, lo cual respalda la teoría de un proceso patogénico que requiere años o incluso décadas para consolidarse.
A pesar de los avances terapéuticos, la tasa relativa de supervivencia global a cinco años para todos los estadios del cáncer pulmonar permanece baja, alrededor del veinticinco por ciento. Esta estadística refleja, en gran parte, el diagnóstico tardío, la limitada eficacia de tratamientos en fases avanzadas y la biología agresiva de ciertos subtipos histológicos, como el carcinoma de células pequeñas. La combinación de una detección precoz limitada, factores etiológicos múltiples y un pronóstico reservado, convierte al cáncer de pulmón en una de las enfermedades oncológicas más desafiantes en la medicina contemporánea.
Clasificación
La clasificación histológica del carcinoma broncogénico, es decir, del cáncer de pulmón originado en el epitelio de los bronquios, se fundamenta en las características morfológicas y celulares observadas al microscopio, y cumple una función esencial tanto en el pronóstico como en la planificación terapéutica. Existen cinco categorías principales reconocidas, las cuales se distinguen no solo por su histogénesis y patrón de crecimiento, sino también por su localización, comportamiento clínico y respuesta al tratamiento.
1. Carcinoma de células escamosas
Este tipo de neoplasia se origina en el epitelio escamoso de revestimiento de los bronquios principales o lobares, habitualmente en regiones centrales del árbol traqueobronquial. Su evolución suele estar precedida por una secuencia metaplásica y displásica del epitelio, lo cual es característico en pacientes fumadores crónicos. Al crecer, estas lesiones tienden a formar masas intraluminales que pueden obstruir los bronquios, provocando colapso pulmonar (atelectasia) o infecciones postobstructivas. Clínicamente, la hemoptisis (expectoración con sangre) es una manifestación frecuente, dada su localización endobronquial. En términos histológicos, se observa queratinización y la presencia de puentes intercelulares, signos típicos de diferenciación escamosa.
2. Adenocarcinoma
El adenocarcinoma es actualmente el subtipo más frecuente de cáncer pulmonar, especialmente en personas no fumadoras y en mujeres. Se origina a partir de células glandulares que secretan moco, o de cualquier célula epitelial situada más allá de los bronquios terminales, incluyendo las células alveolares tipo II o las células de Clara. Morfológicamente, suele presentarse como nódulos periféricos en los lóbulos pulmonares, y puede detectarse incidentalmente en estudios por imágenes. Dentro de esta categoría se incluye el adenocarcinoma in situ, anteriormente conocido como carcinoma bronquioloalveolar. Esta variante se disemina a lo largo de las paredes alveolares conservando la arquitectura pulmonar (crecimiento lepídico), y se caracteriza por una ausencia de invasión estromal. En general, los adenocarcinomas presentan un crecimiento más lento que otros tipos de carcinoma, pero tienen una tendencia precoz a la diseminación linfática y hematógena.
3. Carcinoma de células grandes
Este grupo representa un conjunto heterogéneo de tumores indiferenciados que no exhiben características microscópicas propias del carcinoma escamoso, del adenocarcinoma ni del carcinoma de células pequeñas. Sus células presentan núcleos grandes, nucléolos prominentes y citoplasma abundante, sin signos de diferenciación específica. Debido a su falta de marcadores diferenciadores, se catalogan como “células grandes”. Se pueden localizar tanto en regiones centrales como periféricas del pulmón y tienden a crecer rápidamente, lo que los convierte en tumores particularmente agresivos. Su tasa de duplicación celular es elevada, lo cual se asocia con una rápida progresión clínica y una menor respuesta a los tratamientos convencionales.
4. Carcinoma no mejor diferenciado
En esta categoría se incluyen aquellos tumores que, tras una evaluación histopatológica exhaustiva, no pueden clasificarse en ninguna de las subcategorías anteriores y no presentan las características específicas del carcinoma de células pequeñas. Se consideran un diagnóstico de exclusión, y su presencia refleja la naturaleza a veces ambigua o indiferenciada de ciertos tumores pulmonares. Su comportamiento biológico varía, pero generalmente se tratan como parte del grupo de carcinomas no microcíticos, debido a la falta de rasgos que definan una conducta clínica distinta.
5. Carcinoma de células pequeñas
Este tipo representa una entidad clínica y biológica única. Su origen está en las células neuroendocrinas del epitelio bronquial, y se localiza comúnmente en las regiones centrales del pulmón. El carcinoma de células pequeñas se caracteriza por su infiltración submucosa extensa, lo que provoca el estrechamiento del bronquio afectado sin generar necesariamente una masa evidente. Microscopicamente, sus células son pequeñas, con escaso citoplasma, núcleos hipercromáticos y un patrón de crecimiento en láminas o rosetas. Este subtipo posee una elevada tasa mitótica y una marcada propensión a la diseminación precoz tanto a nivel ganglionar como a distancia (por vía hematógena). Es extremadamente agresivo, y sin tratamiento, la supervivencia media de los pacientes oscila entre seis y dieciocho semanas. No obstante, a pesar de su virulencia, responde inicialmente de forma favorable a la quimioterapia y la radioterapia, lo que justifica su clasificación terapéutica independiente.
Clasificación práctica: Carcinoma de células pequeñas vs. carcinoma no microcítico
Desde un enfoque clínico y terapéutico, los carcinomas broncogénicos se agrupan funcionalmente en dos grandes categorías:
- Carcinoma de células pequeñas, debido a su comportamiento clínico agresivo, su sensibilidad a tratamientos sistémicos y su propensión a la metástasis precoz.
- Carcinoma no microcítico, que incluye los carcinomas escamosos, adenocarcinomas, carcinomas de células grandes y aquellos no mejor diferenciados.
Esta clasificación binaria responde a diferencias fundamentales en la evolución natural, el manejo clínico y la respuesta a las modalidades terapéuticas. Mientras que el carcinoma de células pequeñas se trata predominantemente con regímenes sistémicos, incluso en estadios limitados, los carcinomas no microcíticos son más susceptibles a estrategias quirúrgicas, sobre todo si son detectados en fases tempranas.
En suma, la categorización histológica del cáncer de pulmón no solo permite comprender la biología tumoral subyacente, sino que constituye una herramienta decisiva en la elección del tratamiento y en la estimación del pronóstico individual del paciente.
Manifestaciones clínicas
El cáncer de pulmón, en la mayoría de los casos, se manifiesta con síntomas clínicos evidentes al momento del diagnóstico. Esta presentación sintomática refleja la evolución silenciosa de la enfermedad durante sus fases iniciales, así como la naturaleza localmente invasiva y sistémicamente agresiva de muchos de sus subtipos histológicos. La variedad y complejidad del cuadro clínico dependen fundamentalmente de tres factores interrelacionados: el tipo histológico y la ubicación anatómica del tumor primario, el grado de diseminación local y a distancia, y la presencia de síndromes paraneoplásicos, los cuales representan alteraciones funcionales sistémicas no directamente atribuibles a la invasión tumoral.
Manifestaciones generales y sistémicas
Entre los signos y síntomas más comunes, destacan la anorexia (falta de apetito), la pérdida involuntaria de peso y la astenia o fatiga profunda, presentes en un rango amplio de pacientes, entre el cincuenta y cinco por ciento y el noventa por ciento. Estas manifestaciones no específicas reflejan un estado hipermetabólico inducido por la neoplasia, caracterizado por un catabolismo acelerado, liberación de citoquinas inflamatorias, alteraciones en la síntesis proteica y disfunción del metabolismo energético. Estos síntomas pueden ser los primeros indicios de la enfermedad, aun cuando no haya compromiso pulmonar evidente.
Síntomas respiratorios y torácicos
El compromiso directo de la vía aérea, sobre todo en los carcinomas que se originan en las regiones centrales del árbol bronquial, como el carcinoma de células escamosas o el carcinoma de células pequeñas, se manifiesta con tos de reciente aparición o con una modificación de una tos crónica preexistente, presente hasta en un sesenta por ciento de los pacientes. La hemoptisis —la expectoración de sangre procedente del aparato respiratorio— ocurre en un porcentaje variable, entre el seis y el treinta y uno por ciento, y suele indicar una lesión endobronquial con erosión vascular.
El dolor torácico es otra queja frecuente, presente en un cuarto a un cuarenta por ciento de los pacientes. Puede originarse por invasión de estructuras pleurales, de la pared torácica, o por metástasis óseas, particularmente a las vértebras, las costillas o la pelvis. Estas metástasis osteolíticas son responsables de dolor persistente, frecuentemente nocturno y resistente a los analgésicos convencionales.
Complicaciones por extensión local
La extensión tumoral hacia estructuras adyacentes puede generar una serie de síndromes clínicos bien definidos. La obstrucción endobronquial puede llevar a atelectasia —el colapso del parénquima pulmonar distal— y favorecer el desarrollo de neumonía postobstructiva, caracterizada por fiebre, expectoración purulenta y disnea progresiva. La invasión de la pleura puede provocar la acumulación de líquido pleural (derrame pleural), detectable en un doce a treinta y tres por ciento de los casos. Dependiendo de su volumen y naturaleza, este derrame puede ocasionar disnea, dolor pleurítico y reducción del murmullo vesicular.
Cuando el tumor compromete el nervio laríngeo recurrente, puede producir disfonía o cambios en la voz, debido a parálisis de la cuerda vocal. En casos más avanzados, la invasión o compresión de la vena cava superior puede desencadenar el síndrome de la vena cava superior, caracterizado por ingurgitación venosa supraclavicular, edema facial, cianosis y disnea, que puede agravarse en decúbito. Este cuadro clínico representa una emergencia oncológica por su repercusión hemodinámica y respiratoria.
Otra manifestación asociada a la invasión tumoral de estructuras del sistema nervioso simpático cervical es el síndrome de Horner, que se presenta con ptosis palpebral (caída del párpado), miosis (constricción pupilar) y anhidrosis (ausencia de sudoración) en el lado afectado, reflejo de la disrupción del ganglio estrellado y de la cadena simpática paravertebral.
Metástasis a distancia
El cáncer pulmonar tiene una alta proclividad a la diseminación hematógena. Las metástasis hepáticas suelen manifestarse con síntomas inespecíficos como astenia y pérdida ponderal, sin signos clínicos hepáticos iniciales. Las metástasis cerebrales son relativamente frecuentes: ocurren en aproximadamente un diez por ciento de los pacientes con carcinoma no microcítico, especialmente en aquellos con adenocarcinoma, y en un veinte a treinta por ciento de quienes presentan carcinoma de células pequeñas. Estas metástasis pueden provocar cefalea persistente, náuseas, vómitos, crisis convulsivas, vértigo, alteraciones del estado de conciencia o síntomas neurológicos focales, dependiendo de la localización y tamaño de las lesiones intracraneales.
Síndromes paraneoplásicos
Una dimensión clínica relevante del cáncer pulmonar es la aparición de síndromes paraneoplásicos, los cuales consisten en disfunciones orgánicas sistémicas desencadenadas por productos secretados por el tumor o por mecanismos inmunomediados, y no por invasión directa ni metástasis. Estos síndromes ocurren en un diez a veinte por ciento de los pacientes.
En el carcinoma de células pequeñas, un tumor con diferenciación neuroendocrina, es frecuente la secreción inapropiada de hormona antidiurética, que puede desarrollarse en hasta un quince por ciento de los casos. Esta alteración lleva a hiponatremia dilucional y síntomas neurológicos como confusión, letargia o convulsiones. En el carcinoma escamoso, por otra parte, puede observarse hipercalcemia secundaria a la producción ectópica de proteína relacionada con la hormona paratiroidea.
Otras manifestaciones paraneoplásicas incluyen la acropaquia o «clubbing digital», un engrosamiento indoloro de los extremos distales de los dedos, presente hasta en un veinte por ciento de los pacientes al momento del diagnóstico. También pueden presentarse anemia, estados de hipercoagulabilidad, neuropatías periféricas y el síndrome miasténico de Lambert-Eaton, caracterizado por debilidad muscular proximal y fatigabilidad, debido a autoanticuerpos dirigidos contra los canales de calcio presinápticos.
Exámenes diagnósticos
El diagnóstico definitivo del cáncer de pulmón se basa, de manera indispensable, en la obtención y análisis de una muestra de tejido tumoral o de células malignas a través de técnicas histopatológicas o citológicas. La confirmación morfológica del proceso neoplásico es esencial no solo para establecer el diagnóstico, sino también para determinar el tipo histológico, orientar la estadificación, seleccionar el tratamiento más adecuado y evaluar el pronóstico. Si bien las imágenes radiológicas cumplen un papel crucial en la detección inicial, en la valoración de la extensión de la enfermedad y en la planificación terapéutica, carecen de especificidad diagnóstica y deben ser complementadas con estudios que demuestren la naturaleza maligna de la lesión.
Estudios citológicos
Uno de los métodos diagnósticos más sencillos y menos invasivos es la citología del esputo, especialmente útil en pacientes que presentan expectoración espontánea o tos productiva persistente. Aunque esta técnica posee una alta especificidad, su sensibilidad es limitada, en particular en lesiones que no se comunican con la vía aérea o que se localizan en regiones periféricas del pulmón. Su rendimiento diagnóstico se incrementa significativamente cuando las lesiones se sitúan en las vías respiratorias centrales, como en el caso de carcinomas de células escamosas o de células pequeñas, los cuales suelen crecer intraluminalmente en bronquios de gran calibre.
Técnicas guiadas por imagen
Cuando el tumor se localiza en regiones periféricas del parénquima pulmonar, fuera del alcance de métodos endoscópicos convencionales, se recurre habitualmente a la biopsia transtorácica con aguja fina, guiada por tomografía computarizada. Esta técnica ofrece un rendimiento diagnóstico elevado, con tasas de sensibilidad que pueden alcanzar entre un ochenta y un noventa por ciento. No obstante, presenta un riesgo no despreciable de complicaciones, siendo el neumotórax la más frecuente, con una incidencia de hasta el treinta por ciento, particularmente en pacientes con enfermedad pulmonar obstructiva crónica o enfisema subyacente, en quienes la fragilidad del tejido pulmonar incrementa la probabilidad de colapso pulmonar.
Evaluación de derrames pleurales
En los casos en que el cáncer pulmonar se presenta con un derrame pleural, la toracocentesis —procedimiento que consiste en la extracción de líquido pleural para su análisis— puede proporcionar un diagnóstico mediante la identificación de células malignas en el líquido. Sin embargo, la sensibilidad de esta técnica oscila entre el cincuenta y el sesenta y cinco por ciento, ya que no todos los derrames asociados al cáncer contienen una carga celular suficiente o muestran células malignas en el momento de la extracción. Por ello, en ocasiones es necesario repetir el procedimiento o considerar técnicas más invasivas si los hallazgos no son concluyentes.
Punción con aguja fina de ganglios linfáticos
Cuando se detectan adenopatías palpables en regiones accesibles, como el cuello o la fosa supraclavicular, la aspiración con aguja fina se convierte en una herramienta diagnóstica de gran utilidad. Esta técnica permite obtener material celular sin necesidad de intervención quirúrgica y, en muchos casos, es suficiente para confirmar la presencia de metástasis, evitando procedimientos más complejos.
Broncoscopia y técnicas asociadas
La broncoscopia con fibra óptica constituye una de las herramientas diagnósticas más versátiles en la evaluación del cáncer pulmonar, especialmente en lesiones centrales. Este procedimiento permite la inspección directa de las vías aéreas mayores y posibilita la realización de diversas intervenciones diagnósticas en una sola sesión. Estas incluyen el cepillado de lesiones visibles para análisis citológico, el lavado broncoalveolar de segmentos pulmonares sospechosos, la biopsia directa de lesiones endobronquiales, así como biopsias transbronquiales “a ciegas” del parénquima pulmonar o de nódulos periféricos, y la aspiración de ganglios linfáticos mediastínicos. Sin embargo, su alcance anatómico es limitado en comparación con los tumores periféricos.
Para superar esta limitación, se han desarrollado técnicas como la broncoscopia navegacional electromagnética, que combina imágenes tridimensionales con navegación asistida para acceder a lesiones periféricas de pequeño tamaño con mayor precisión, mejorando así la tasa de éxito diagnóstico sin aumentar sustancialmente el riesgo de complicaciones.
Métodos quirúrgicos
En los casos en que las técnicas menos invasivas no proporcionan resultados concluyentes, puede ser necesario recurrir a procedimientos quirúrgicos, tales como la mediastinoscopia —para biopsiar ganglios mediastínicos—, la cirugía toracoscópica asistida por video, o incluso la toracotomía diagnóstica. Estas técnicas, aunque más invasivas, son fundamentales cuando se requiere una muestra amplia para estudios moleculares o cuando se sospechan diagnósticos alternativos que requieren evaluación histológica detallada del parénquima pulmonar.
Estudios por imagen
En prácticamente todos los pacientes con cáncer pulmonar se detectan alteraciones en las radiografías de tórax o en la tomografía computarizada. Aunque estas modalidades permiten localizar masas, nódulos, adenopatías, derrames pleurales o metástasis a distancia, sus hallazgos rara vez son patognomónicos. Por ello, las imágenes deben interpretarse en el contexto clínico y siempre conducir a una confirmación histológica antes de iniciar un tratamiento específico.
Exámenes especiales
La estadificación precisa del cáncer pulmonar es un proceso clínico esencial que tiene implicancias directas en la toma de decisiones terapéuticas, en la estimación pronóstica del paciente y en la correcta inclusión de los individuos en protocolos de investigación clínica. En oncología torácica, la estadificación no solo describe la extensión anatómica de la enfermedad, sino que estructura la estrategia de abordaje clínico y permite un lenguaje común entre profesionales de distintas disciplinas. Su objetivo es establecer con exactitud si el tumor es local, regionalmente avanzado o metastásico, lo cual condiciona de manera fundamental la posibilidad de intervención quirúrgica, la indicación de tratamiento sistémico o radioterapia, y el pronóstico general del paciente.
Clasificación del cáncer pulmonar no microcítico
En el caso del carcinoma pulmonar no microcítico, se emplea un sistema de estadificación estructurado y universalmente aceptado: la clasificación TNM, desarrollada por el Comité Americano Conjunto sobre el Cáncer (American Joint Committee on Cancer) y la Unión Internacional Contra el Cáncer. Esta clasificación fue actualizada por última vez en su octava edición, vigente desde enero de 2018. Se trata de un sistema descriptivo que evalúa tres componentes fundamentales:
- T (tumor): hace referencia al tamaño del tumor primario y a su grado de invasión local. Incluye consideraciones como el compromiso de estructuras adyacentes, la afectación bronquial, y si hay colapso pulmonar o neumonía asociada.
- N (nódulos linfáticos): evalúa la presencia o ausencia de metástasis a los ganglios linfáticos regionales, así como su localización (hiliares, mediastínicos, supraclaviculares).
- M (metástasis): indica si existe diseminación a distancia, lo cual transforma radicalmente la intención del tratamiento y el pronóstico del paciente.
La combinación de estos tres parámetros permite agrupar los casos en estadios del I al IV, lo que facilita el diseño terapéutico. Los estadios tempranos suelen ser potencialmente resecables, mientras que los estadios avanzados requieren tratamientos sistémicos o cuidados paliativos.
Clasificación del cáncer pulmonar de células pequeñas
En el carcinoma de células pequeñas, dada su agresividad intrínseca y rápida diseminación, históricamente se ha utilizado una clasificación más simplificada:
- Enfermedad limitada: confinada a un solo hemitorax, incluyendo ganglios mediastínicos contralaterales, lo que permite el tratamiento dentro de un solo campo de radioterapia.
- Enfermedad extensa: con afectación que excede el hemitorax, incluye metástasis a distancia y derrames pleurales malignos.
No obstante, se recomienda cada vez más aplicar también el sistema TNM a los casos de carcinoma de células pequeñas, para ofrecer una estadificación más detallada y comparable entre estudios clínicos.
Métodos diagnósticos complementarios
La evaluación integral del paciente requiere una exploración clínica cuidadosa orientada a detectar signos de enfermedad metastásica, como nódulos cutáneos, adenopatías periféricas o dolor óseo. La historia clínica detallada es crucial, ya que el estado funcional del paciente —evaluado mediante escalas de desempeño como el índice de Karnofsky o ECOG— es un determinante clave en la elección del tratamiento y en la supervivencia proyectada.
Desde el punto de vista analítico, es necesario realizar estudios de laboratorio básicos que incluyen biometría hemática completa, electrolitos séricos, niveles de calcio, creatinina, pruebas de función hepática, deshidrogenasa láctica y albúmina. Estos valores no solo orientan sobre el estado general del paciente, sino que también pueden revelar alteraciones asociadas a síndromes paraneoplásicos o disfunción orgánica por metástasis.
Evaluación por imágenes
La tomografía computarizada de tórax con contraste es la piedra angular para la estadificación anatómica inicial. Sin embargo, sus limitaciones en cuanto a sensibilidad (alrededor del cincuenta y siete por ciento) y especificidad (en torno al ochenta y dos por ciento) en la detección de metástasis ganglionares mediastínicas hacen que no pueda considerarse como método único ni definitivo. Su principal utilidad radica en definir las zonas a biopsiar, establecer relaciones anatómicas para la planificación quirúrgica, y sugerir la vía de abordaje más segura.
Para complementar esta limitación, se utiliza la tomografía por emisión de positrones combinada con tomografía computarizada (PET/CT) con fluorodesoxiglucosa marcada con flúor-18. Esta herramienta permite evaluar la actividad metabólica de lesiones sospechosas, identificando focos hipermetabólicos indicativos de infiltración tumoral tanto en ganglios mediastínicos como en sitios a distancia. La precisión diagnóstica de la PET/CT varía según el tamaño de los ganglios: si estos miden menos de un centímetro, la sensibilidad es del setenta y cuatro por ciento y la especificidad del noventa y seis por ciento; si superan el centímetro, la sensibilidad asciende al noventa y cinco por ciento, aunque con una menor especificidad (setenta y seis por ciento), debido a posibles falsos positivos por inflamación o infección.
Evaluación del sistema nervioso central
Dado que el cerebro es un sitio frecuente de metástasis en el cáncer pulmonar, especialmente en el carcinoma de células pequeñas y en el carcinoma no microcítico de estadio avanzado o con histología poco diferenciada, se recomienda realizar una resonancia magnética cerebral como parte del estudio de estadificación. Este examen permite identificar lesiones intracraneales asintomáticas y modificar significativamente el plan terapéutico, al cambiar un escenario potencialmente curable por uno de tratamiento paliativo.
Evaluación funcional pulmonar
Una proporción significativa de los pacientes con carcinoma pulmonar no microcítico presenta enfermedades pulmonares crónicas subyacentes, principalmente como consecuencia de una exposición prolongada al tabaco. Estas patologías, como la enfermedad pulmonar obstructiva crónica o la fibrosis pulmonar, condicionan el estado funcional respiratorio del paciente y, por ende, modifican el riesgo quirúrgico y la tolerancia a una posible resección pulmonar.
Antes de considerar cualquier tratamiento quirúrgico —particularmente lobectomías o neumonectomías, que implican una reducción importante del volumen pulmonar funcional— es indispensable realizar pruebas de función respiratoria, con énfasis en la espirometría. Este estudio permite cuantificar parámetros clave como el volumen espiratorio forzado en un segundo (FEV1), que representa un indicador confiable de la reserva ventilatoria del paciente.
En términos generales, los pacientes que no presentan comorbilidades significativas y que poseen un FEV1 preoperatorio igual o superior a dos litros tienen un riesgo bajo de desarrollar complicaciones respiratorias postoperatorias graves. En ellos, los procedimientos quirúrgicos mayores como la lobectomía o incluso la neumonectomía son considerados seguros desde el punto de vista funcional. Por el contrario, valores más bajos de FEV1, especialmente por debajo del 40 % del valor teórico, requieren estudios adicionales, como pruebas de difusión pulmonar o pruebas de esfuerzo cardiopulmonar, para definir con precisión la viabilidad de la resección quirúrgica.
La evaluación funcional, por lo tanto, no solo determina si el paciente podrá sobrevivir a la cirugía desde un punto de vista respiratorio, sino también si tendrá una calidad de vida aceptable después de la intervención. En este sentido, cumple un papel clave en la toma de decisiones clínicas, evitando intervenciones desproporcionadas en pacientes con función pulmonar muy limitada.
Tamizaje con tomografía computarizada de baja dosis
Por otra parte, el tamizaje del cáncer de pulmón mediante tomografía computarizada helicoidal de baja dosis representa uno de los avances más relevantes en la oncología pulmonar preventiva. A diferencia de otros métodos de detección más antiguos, como la radiografía de tórax, esta técnica ha demostrado de manera robusta su eficacia en la reducción de la mortalidad específica por cáncer pulmonar.
El estudio más influyente en este campo, el National Lung Screening Trial (ensayo nacional de tamizaje pulmonar), fue un ensayo clínico aleatorizado multicéntrico realizado en los Estados Unidos que incluyó a más de cincuenta y tres mil participantes, todos ellos fumadores activos o exfumadores con antecedentes de consumo importante. Este estudio reveló que realizar un tamizaje anual con tomografía helicoidal de baja dosis durante tres años consecutivos permitió una reducción relativa del veinte por ciento en la mortalidad por cáncer pulmonar, así como una disminución global del 6.7 % en la mortalidad por todas las causas, en comparación con quienes se sometieron únicamente a radiografía de tórax convencional.
Estos resultados llevaron a múltiples sociedades científicas y organismos reguladores a recomendar el uso sistemático de esta modalidad de imagen en individuos con alto riesgo. Las recomendaciones más actualizadas del Grupo de Trabajo de Servicios Preventivos de los Estados Unidos (USPSTF, por sus siglas en inglés), emitidas en 2021, establecen que deben someterse a tamizaje anual las personas entre cincuenta y ochenta años de edad que tengan un historial de tabaquismo equivalente a veinte paquetes-año o más, y que sean fumadores activos o hayan dejado de fumar en los últimos quince años.
Es fundamental señalar que cualquier programa de detección debe ir necesariamente acompañado de estrategias integradas de cesación tabáquica. Detectar el cáncer en etapas precoces puede mejorar la supervivencia, pero prevenir su aparición mediante la eliminación del factor de riesgo primario —el consumo de tabaco— sigue siendo la intervención más eficaz. Por ello, el asesoramiento sobre abandono del tabaquismo, el acceso a terapias sustitutivas de nicotina, y la intervención conductual deben ser componentes estructurales de cualquier iniciativa de tamizaje poblacional.

Fuente y lecturas recomendadas:
- Forde PM et al; CheckMate 816 Investigators. Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med. 2022;386:1973. [PMID: 35403841]
- Skoulidis F et al. Sotorasib for lung cancers with KRAS p.G12C mutation. N Engl J Med. 2021;384:2371. [PMID: 34096690]
- US Preventive Services Task Force; Krist AH et al. Screening for lung cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 2021;325:962. [PMID: 33687470]
- Wakelee H et al. Perioperative pembrolizumab for early-stage non-small-cell lung cancer. N Engl J Med. 2023;389:491. [PMID: 37272513]