La glomerulonefritis necrotizante pauciinmune es una manifestación renal característica de un grupo de vasculitis asociadas a anticuerpos anti-citoplasmáticos (ANCA, por sus siglas en inglés), que incluyen la granulomatosis con poliangeítis, la poliangeítis microscópica y la granulomatosis eosinofílica con poliangeítis. Estas enfermedades autoinmunes están asociadas con la presencia de anticuerpos dirigidos contra antígenos intracelulares, como la proteinasa-3 (PR3) y la mieloperoxidasa (MPO), que se encuentran en los neutrófilos y otras células inmunológicas. La patogénesis de la glomerulonefritis necrotizante pauci-inmune implica un complejo proceso en el que los neutrófilos, previamente primados por citoquinas, juegan un papel central en la injuria vascular y renal.
En condiciones normales, los neutrófilos son células del sistema inmunológico que desempeñan una función clave en la defensa contra infecciones, mediante mecanismos como la fagocitosis y la liberación de radicales libres en un proceso conocido como «explosión respiratoria» o «burst respiratorio». En el contexto de las vasculitis asociadas a ANCA, la activación de estos neutrófilos está mediada por la unión de los anticuerpos anticitoplasmáticos (ANCAs) a antígenos como la PR3 y la MPO, que se encuentran en los gránulos azurófilos de los neutrófilos. Esta interacción activa el neutrófilo y desencadena una serie de reacciones inflamatorias, incluida la liberación de especies reactivas de oxígeno y la posterior lesión de los vasos sanguíneos y los glomérulos renales.
Un aspecto distintivo de la glomerulonefritis necrotizante pauci-inmune es la escasa o nula deposición de inmunoglobulinas y componentes del sistema del complemento en los riñones afectados. Esto se observa a través de la técnica de inmunofluorescencia en las biopsias renales, y de ahí proviene el término «pauci-inmune», que significa «pocos inmunocomplejos». Esto distingue a la glomerulonefritis pauci-inmune de otros tipos de glomerulonefritis, como la asociada a enfermedades autoinmunes sistémicas como el lupus eritematoso sistémico, que típicamente presenta una intensa deposición de inmunoglobulinas y complemento en los glomérulos.
El patrón clásico de presentación clínica de la glomerulonefritis asociada a ANCA es la glomerulonefritis rápidamente progresiva (RPGN), una forma agresiva de daño renal caracterizada por la rápida pérdida de la función renal y la aparición de hematuria, proteinuria y síndrome nefrítico. Sin embargo, también pueden presentarse formas más indolentes de la enfermedad, donde la progresión renal es más lenta y los síntomas pueden ser menos evidentes.
Aunque la mayoría de los casos de vasculitis asociada a ANCA son idiopáticos, es decir, no tienen una causa claramente identificable, algunos factores pueden predisponer a la aparición de estas enfermedades. Entre estos factores se incluyen infecciones virales, como la infección por el virus SARS-CoV-2 (causante de la COVID-19), exposiciones ambientales, como la inhalación de polvo de sílice, y la exposición a ciertos fármacos. Estas exposiciones pueden actuar como desencadenantes en individuos genéticamente predispuestos, alterando la función de los neutrófilos y favoreciendo la respuesta autoinmunitaria dirigida contra los antígenos intracelulares.
El papel central de los neutrófilos en la patogénesis de la glomerulonefritis asociada a ANCA ha llevado a la exploración de posibles terapias dirigidas a modular su activación, como los inhibidores de la migración de neutrófilos, los anticuerpos monoclonales dirigidos contra las moléculas de adhesión de los neutrófilos, o los fármacos que bloquean la función de los anticuerpos ANCA. Sin embargo, la terapia estándar sigue siendo el uso de agentes inmunosupresores, como los corticosteroides y los agentes citotóxicos, para reducir la inflamación sistémica y prevenir el daño renal irreversible.
Manifestaciones clínicas
Las enfermedades inflamatorias sistémicas, como las vasculitis asociadas a anticuerpos anticitoplasmáticos, se caracterizan por una respuesta inmunitaria anómala que afecta a múltiples sistemas orgánicos. Esta respuesta inflamatoria generalizada puede dar lugar a una variedad de síntomas sistémicos que se manifiestan antes de que se realice un diagnóstico formal de la enfermedad. Entre los síntomas más comunes, se encuentran la fiebre, el malestar generalizado y la pérdida de peso, que pueden persistir durante varios meses. Estos síntomas son indicativos de una inflamación crónica y activa en el organismo, y suelen ser poco específicos, lo que puede dificultar la identificación temprana de la causa subyacente, ya que se pueden observar en una variedad de condiciones médicas.
En el contexto de la vasculitis, el daño vascular es uno de los mecanismos principales que subyace a la patogénesis. En la glomerulonefritis asociada a ANCA, por ejemplo, los signos de inflamación glomerular, como la hematuria (presencia de sangre en la orina) y la proteinuria (exceso de proteínas en la orina), son comunes, y son indicativos de daño renal directo. Sin embargo, la afectación de otros vasos sanguíneos más allá de los glomérulos también es frecuente. La inflamación de los capilares dérmicos, que son pequeños vasos sanguíneos en la piel, puede causar púrpura, que se manifiesta como manchas o moretones violáceos en la piel debido a la extravasación de sangre. Además, la vasculitis puede involucrar pequeñas arteriolas nerviosas, lo que da lugar a la mononeuritis múltiple, una condición que se caracteriza por la inflamación de nervios periféricos individuales, lo que puede causar dolor, debilidad y disfunción en áreas específicas del cuerpo.
En el caso de la granulomatosis con poliangeítis, una de las formas más comunes de vasculitis asociada a ANCA, el 90% de los pacientes presenta síntomas respiratorios, que pueden involucrar tanto el tracto respiratorio superior como el inferior. Las lesiones nodulares en los pulmones, que a menudo se desarrollan en el contexto de esta enfermedad, pueden cavitar y sangrar, lo que agrava aún más la presentación clínica. La cavitación de estas lesiones pulmonares puede conducir a hemorragias alveolares, una complicación grave que se manifiesta como hemoptisis, es decir, la expectoración de sangre. La hemoptisis es un signo preocupante que sugiere que la inflamación y el daño vascular han alcanzado los pulmones en una forma lo suficientemente grave como para causar sangrado en los alvéolos, las estructuras responsables del intercambio gaseoso en los pulmones. Esta complicación es potencialmente mortal y suele requerir hospitalización urgente y tratamiento agresivo con inmunosupresores para reducir la inflamación y controlar el daño.
La combinación de síntomas respiratorios, signos sistémicos de inflamación, y manifestaciones dermatológicas y neurológicas puede ser un reto diagnóstico, ya que estos síntomas son comunes a varias enfermedades autoinmunes e infecciosas. No obstante, la presencia de lesiones pulmonares cavitadas, hemoptisis, y la identificación de la vasculitis como un proceso subyacente a través de biopsias o análisis de anticuerpos, como los ANCA, es crucial para el diagnóstico definitivo.
Exámenes diagnósticos
El análisis serológico de los subtipos de anticuerpos anticitoplasmáticos (ANCA, por sus siglas en inglés) es una herramienta clave para el diagnóstico y la clasificación de las vasculitis asociadas a ANCA, como la granulomatosis con poliangeítis y la poliangeítis microscópica. Los ANCA son anticuerpos dirigidos contra antígenos citoplasmáticos específicos en los neutrófilos, y se dividen en dos grandes categorías según el antígeno diana: los anticuerpos antiproteinasa-3 (PR3-ANCA) y los anticuerpos antimieloperoxidasa (MPO-ANCA).
En el contexto de la granulomatosis con poliangeítis, una de las formas más prevalentes de vasculitis asociada a ANCA, la mayoría de los pacientes presentan anticuerpos PR3-ANCA. Estos anticuerpos están dirigidos contra la proteinasa-3, una enzima que se encuentra principalmente en los gránulos de los neutrófilos y en los monocitos. La presencia de PR3-ANCA en la circulación es altamente sugerente de granulomatosis con poliangeítis y, por lo tanto, su detección en un paciente con sospecha clínica de vasculitis puede confirmar el diagnóstico. Sin embargo, un número menor de pacientes con granulomatosis con poliangeítis puede ser negativo para PR3-ANCA y, en su lugar, pueden presentar MPO-ANCA, aunque esto es menos frecuente. En casos muy raros, algunos pacientes pueden no tener ningún ANCA detectable en su suero, lo que puede complicar el diagnóstico.
Por otro lado, la poliangeítis microscópica, que es otra forma de vasculitis asociada a ANCA, se asocia casi exclusivamente con MPO-ANCA. En esta enfermedad, los anticuerpos antimieloperoxidasa están dirigidos contra la mieloperoxidasa, una enzima presente en los gránulos de los neutrófilos y que juega un papel crucial en la respuesta inmunitaria. La presencia de MPO-ANCA en pacientes con sospecha de vasculitis sugiere un diagnóstico de poliangeítis microscópica y es un marcador serológico útil para diferenciar esta entidad de otras vasculitis asociadas a ANCA, como la granulomatosis con poliangeítis.
El análisis serológico para los subtipos de ANCA no solo tiene valor diagnóstico, sino que también puede ayudar a comprender mejor la patogénesis de la enfermedad y orientar el tratamiento. Por ejemplo, la identificación de PR3-ANCA en un paciente con granulomatosis con poliangeítis puede ser útil para guiar la elección de terapias inmunosupresoras, dado que la enfermedad tiende a tener un curso más agresivo y una mayor probabilidad de afectación respiratoria y renal.
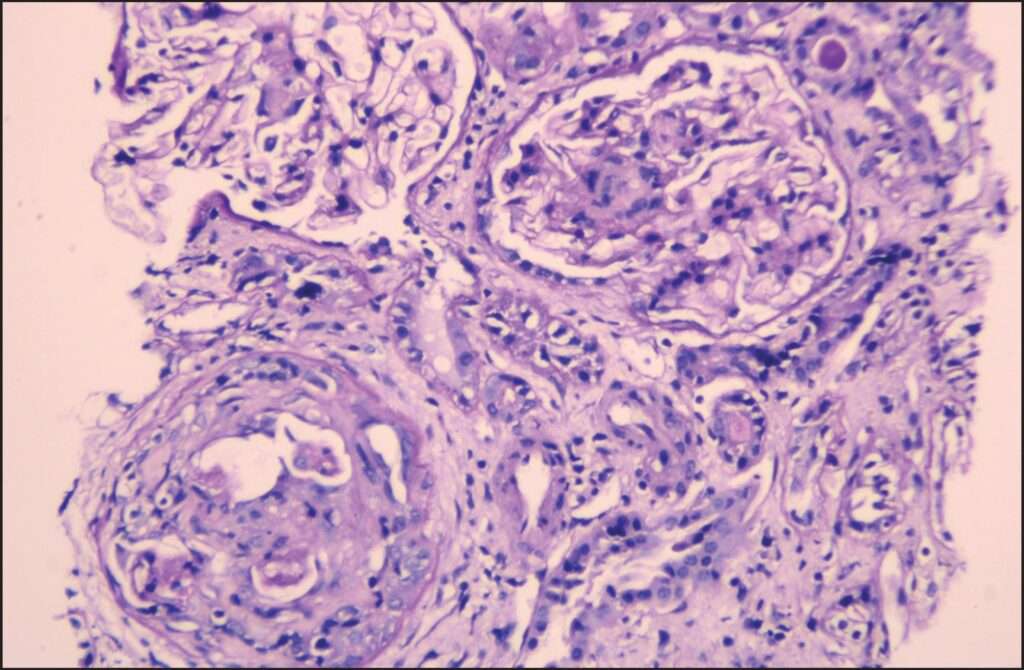
Además de los estudios serológicos, el diagnóstico definitivo de la vasculitis asociada a ANCA generalmente requiere la realización de una biopsia renal, especialmente cuando hay signos de daño renal, como la hematuria y la proteinuria. En la biopsia renal de pacientes con estas condiciones, la microscopía óptica revela lesiones necrotizantes en los glomérulos y la presencia de semilunas, que son formaciones extracelulares que resultan de la proliferación de células parietales y la fuga de proteínas y componentes celulares. Estas semilunas son un hallazgo característico de la glomerulonefritis rápidamente progresiva (RPGN), que se asocia con la vasculitis severa.
A pesar de la presencia de estas lesiones en la biopsia renal, un aspecto distintivo de la glomerulonefritis asociada a ANCA es la falta de depósitos inmunes en el tejido renal. Cuando se realiza una técnica de inmunofluorescencia en la biopsia renal, no se observan depósitos de inmunoglobulinas ni de componentes del sistema del complemento, lo que lleva a la clasificación de la glomerulonefritis como «pauci-inmune». Este hallazgo es fundamental para diferenciar la glomerulonefritis asociada a ANCA de otras formas de glomerulonefritis, como las que se observan en enfermedades autoinmunes sistémicas, como el lupus eritematoso sistémico, donde los depósitos de inmunocomplejos son más prominentes.
Tratamiento
El inicio temprano del tratamiento en las vasculitis asociadas a anticuerpos anticitoplasmáticos es esencial debido a la naturaleza agresiva y potencialmente fatal de estas enfermedades. La glomerulonefritis rápidamente progresiva y las complicaciones sistémicas, como la hemorragia alveolar difusa, pueden avanzar de manera rápida, lo que hace imprescindible un tratamiento urgente para evitar el daño irreversible en los órganos afectados, particularmente en los riñones y los pulmones. En este contexto, se recomienda un enfoque terapéutico de inducción que se extiende entre tres y seis meses, con el objetivo de controlar la inflamación activa y reducir el daño orgánico.
La terapia de inducción generalmente incluye el uso de corticosteroides y agentes inmunosupresores más potentes, como la ciclofosfamida o el rituximab. Los corticosteroides, como los prednisolones, son esenciales debido a su capacidad para disminuir la inflamación generalizada y suprimir la respuesta inmunitaria. La ciclofosfamida, un agente citotóxico que interfiere con la replicación celular, ha sido durante mucho tiempo un pilar en el tratamiento de las vasculitis asociadas a ANCA, ya que reduce la proliferación de las células inmunológicas responsables de la lesión vascular. Sin embargo, en los últimos años, el rituximab, un anticuerpo monoclonal que depleciona las células B, se ha utilizado cada vez más como una opción preferida debido a su eficacia y a un perfil de efectos secundarios potencialmente más favorable en comparación con la ciclofosfamida.
Tras la fase de inducción, que se centra en el control inmediato de la inflamación, se sigue una terapia de mantenimiento para prevenir las recaídas. En este sentido, el rituximab se considera la opción preferida para el tratamiento a largo plazo debido a su eficacia en la reducción de la recaída de la enfermedad y su capacidad para mantener una supresión inmunológica duradera. Alternativamente, la azatioprina, un agente inmunosupresor que inhibe la síntesis de ADN y la proliferación celular, puede ser utilizada, aunque su perfil de efectos secundarios es más significativo que el del rituximab, lo que la convierte en una opción menos preferida para el tratamiento de mantenimiento en comparación con este último.
En cuanto al uso de inhibidores del complemento, el avacopan, un inhibidor selectivo del receptor C5a del complemento, se ha presentado como una alternativa potencial a los corticosteroides durante la fase de inducción. El avacopan actúa bloqueando la activación del complemento y la inflamación mediada por el C5a, lo que puede reducir la necesidad de corticosteroides y minimizar los efectos secundarios asociados con el uso prolongado de estos fármacos. Aunque su uso en la práctica clínica todavía está siendo evaluado, se ha mostrado prometedor en algunos estudios, lo que sugiere que puede ser una opción válida para algunos pacientes con vasculitis asociada a ANCA, especialmente en aquellos que presentan efectos secundarios intolerables con corticosteroides.
Por otro lado, el papel de la plasmaféresis en el tratamiento de la vasculitis asociada a ANCA sigue siendo un tema de debate. La plasmaféresis, que implica la extracción y el reemplazo del plasma sanguíneo, ha sido utilizada para tratar casos graves, como aquellos con hemorragia alveolar difusa, una complicación en la que el sangrado en los pulmones pone en riesgo la vida del paciente. La plasmaféresis se cree que ayuda a eliminar los anticuerpos patológicos circulantes, incluidos los ANCA, y puede mejorar la función pulmonar en estos pacientes. Sin embargo, su indicación y efectividad en otros aspectos de la vasculitis asociada a ANCA no están completamente establecidas, y su uso puede variar según la gravedad de la enfermedad y la respuesta a otras terapias.
Además, si en un paciente se detectan anticuerpos anti-membrana basal glomerular (anti-GBM), la plasmaféresis se convierte en parte estándar del tratamiento. La combinación de vasculitis asociada a ANCA con anticuerpos anti-GBM es una condición rara pero grave, que se denomina síndrome de Goodpasture, y requiere un enfoque terapéutico intensivo. En estos casos, la plasmaféresis se utiliza para eliminar los anticuerpos anti-GBM, lo que puede reducir el daño renal y pulmonar y mejorar el pronóstico del paciente.
Pronóstico
Sin un tratamiento adecuado, el pronóstico de las vasculitis asociadas a anticuerpos anticitoplasmáticos es extremadamente pobre. Estas enfermedades son potencialmente mortales debido a su naturaleza agresiva, que afecta a varios órganos, especialmente los riñones y los pulmones. La glomerulonefritis rápidamente progresiva, que es una manifestación común en estos trastornos, puede conducir rápidamente a insuficiencia renal irreversible si no se interviene a tiempo. Además, las complicaciones pulmonares, como la hemorragia alveolar difusa, también representan un riesgo importante para la vida del paciente. Sin tratamiento, la mortalidad a corto plazo es alta debido a la rápida progresión de la enfermedad y el daño multiorgánico que puede ocurrir en poco tiempo.
Sin embargo, con un tratamiento agresivo e inicial adecuado, la mayoría de los pacientes pueden alcanzar una remisión completa, lo que mejora considerablemente el pronóstico. El tratamiento estándar, que incluye corticosteroides y agentes inmunosupresores como la ciclofosfamida o el rituximab, está diseñado para reducir la inflamación sistémica y controlar la respuesta inmunitaria subyacente que provoca la vasculitis. En muchos casos, este enfoque terapéutico puede conducir a la resolución de los síntomas y la estabilización de la función renal, incluso en casos graves. De hecho, la remisión completa es alcanzable en la mayoría de los pacientes si se inicia un tratamiento adecuado en las fases tempranas de la enfermedad. La rapidez en la intervención es crucial para reducir el riesgo de daño irreversible y mejorar las perspectivas a largo plazo.
El pronóstico a largo plazo, sin embargo, depende en gran medida de la extensión del daño renal antes de iniciar el tratamiento. Los pacientes que presentan una insuficiencia renal avanzada en el momento del diagnóstico, especialmente aquellos con glomerulonefritis rápidamente progresiva, tienen un pronóstico menos favorable. La presencia de semilunas en la biopsia renal, que son un signo de daño glomerular extenso, a menudo se asocia con un curso clínico más grave y una mayor probabilidad de insuficiencia renal crónica. Por lo tanto, la intervención temprana es crucial, ya que el daño renal preexistente tiene un impacto directo en la capacidad de recuperación del paciente.
Además, la patogénesis de las vasculitis asociadas a ANCA puede variar según el subtipo de los anticuerpos presentes. En los pacientes con enfermedad asociada a anticuerpos antiproteinasa-3 (PR3-ANCA), que es más común en la granulomatosis con poliangeítis, el pronóstico puede ser peor en comparación con aquellos con anticuerpos antimieloperoxidasa (MPO-ANCA). Esto se debe a que la enfermedad asociada a PR3 tiende a tener un curso clínico más agresivo, con una mayor tendencia a la afectación pulmonar y renal, lo que puede dificultar el tratamiento y aumentar el riesgo de complicaciones. Así, la identificación temprana del subtipo de ANCA en cada paciente es importante no solo para el diagnóstico, sino también para la estratificación del riesgo y la planificación del tratamiento.
El monitoreo de los títulos de ANCA durante el tratamiento es una herramienta útil, pero tiene limitaciones. Aunque la disminución de los títulos de ANCA se asocia generalmente con una respuesta favorable al tratamiento, los títulos de ANCA no son completamente predictivos de la recurrencia de la enfermedad. Los pacientes pueden experimentar una remisión clínica a pesar de que los títulos de ANCA permanezcan elevados, o, por el contrario, los títulos pueden disminuir sin que esto garantice la ausencia de recaídas. Por lo tanto, la medición de los títulos de ANCA debe interpretarse con cautela y siempre en el contexto de otros datos clínicos, como la sedimentación urinaria, que puede proporcionar información más directa sobre la función renal y la presencia de actividad inflamatoria en los riñones.
La sedimentación urinaria, que incluye la evaluación de la hematuria, la proteinuria y la presencia de cilindros en la orina, es un indicador más confiable de la actividad de la enfermedad renal en pacientes con vasculitis asociada a ANCA. La persistencia de estos signos en la orina puede sugerir que la inflamación renal sigue activa, lo que podría indicar la necesidad de ajustar el tratamiento o considerar estrategias adicionales, como la plasmaféresis en casos graves.

Fuente y lecturas recomendadas:
- Chevet B et al. Diagnosing and treating ANCA-associated vasculitis: an updated review for clinical practice. Rheumatology. 2023;62:1787. [PMID: 26315063]
- Mazzariol M et al. The complement system in antineutrophil cytoplasmic antibody vasculitis: pathogenic player and therapeutic target. Curr Opin Rheumatol. 2023;35:31. [PMID: 36301247]
- Moura MC et al. Management of antineutrophil cytoplasmic antibody-associated vasculitis with glomerulonephritis as proposed by the ACR 2021, EULAR 2022 and KDIGO 2021 guidelines/recommendations. Nephrol Dial Transplant. 2023;38:2637. [PMID: 37164940]
Originally posted on 29 de marzo de 2025 @ 12:17 AM