La glomerulonefritis asociada a anticuerpos anti-GBM (membrana basal glomerular) es una enfermedad autoinmunitaria grave que involucra una respuesta inmunológica dirigida contra los epítopos de la membrana basal glomerular. Este tipo de glomerulonefritis, conocida también como enfermedad anti-GBM, se caracteriza por la formación de anticuerpos que atacan la estructura de la membrana basal glomerular en los riñones. La membrana basal glomerular es una parte crucial de la barrera de filtración renal, y su daño puede alterar significativamente la función renal, resultando en insuficiencia renal aguda y síndrome nefrítico.
El mecanismo patológico de la enfermedad anti-GBM implica una respuesta inmune en la que los anticuerpos se dirigen contra epítopos específicos presentes en la membrana basal glomerular, principalmente el colágeno tipo IV, que es un componente esencial de la estructura de la membrana basal glomerular. La unión de estos anticuerpos a la membrana basal glomerular desencadena una serie de eventos inflamatorios mediada por la activación del sistema del complemento, lo que da lugar a un daño tisular local. Este daño provoca la proliferación de células mesangiales, la infiltración de leucocitos, y la formación de semilunas en los glomérulos, lo que resulta en una disminución de la capacidad de filtración renal y la aparición de signos clínicos característicos, como hematuria, proteinuria y síndrome nefrítico.
En el contexto de esta patología, existe una complicación adicional significativa conocida como síndrome de Goodpasture. Esta condición se asocia no solo con la glomerulonefritis anti-GBM, sino también con hemorragia pulmonar. La razón de este fenómeno se debe a la presencia de los mismos anticuerpos dirigidos contra la membrana basal glomerular, que también atacan las membranas basales alveolares en los pulmones. El daño a las membranas basales alveolares causa hemorragia pulmonar, lo que se traduce en una manifestación clínica característica de dificultad respiratoria, tos con sangre y, en casos graves, insuficiencia respiratoria. La combinación de glomerulonefritis y hemorragia pulmonar define el síndrome de Goodpasture, una condición potencialmente fatal si no se trata de manera oportuna.
En cuanto a la epidemiología de la glomerulonefritis asociada a anticuerpos anti-GBM, se observa una distribución bimodal en su incidencia. Un pico de la enfermedad se presenta en la tercera década de la vida, con una mayor prevalencia en hombres y con una mayor frecuencia de implicación pulmonar. Este primer pico sugiere que factores hormonales y genéticos podrían estar involucrados en la mayor susceptibilidad de los hombres en este grupo de edad, así como una posible relación con la exposición a factores ambientales que favorecen la aparición de la enfermedad, como infecciones pulmonares o el consumo de tabaco. Posteriormente, se produce otro pico en la sexta y séptima década de la vida, donde la enfermedad afecta a ambos sexos por igual y la implicación pulmonar es menos frecuente. Esta segunda fase podría estar vinculada a una mayor susceptibilidad relacionada con la edad, además de la acumulación de factores genéticos y ambientales que modulan la respuesta inmune a lo largo de la vida.
Diversos factores de riesgo y predisposición genética se han identificado en la aparición de la glomerulonefritis anti-GBM y el síndrome de Goodpasture. Se ha demostrado que la exposición a ciertos agentes ambientales puede desencadenar o agravar la enfermedad. La infección pulmonar, el consumo de tabaco, y la exposición a solventes orgánicos, como los hidrocarburos, son factores que se asocian con un mayor riesgo de desarrollar estas condiciones. Además, el uso de fármacos como el alemtuzumab, un anticuerpo monoclonal utilizado en el tratamiento de enfermedades autoinmunitarias y ciertos tipos de cáncer, también se ha vinculado con la aparición de esta enfermedad.
En términos de predisposición genética, los antígenos HLA-DR2 y HLA-B7 se han identificado como posibles factores de susceptibilidad. Estos antígenos son variantes genéticas que juegan un papel crucial en la presentación de antígenos a las células T del sistema inmunológico. La presencia de estos alelos específicos podría predisponer a los individuos a desarrollar una respuesta inmune anómala que da lugar a la formación de anticuerpos anti-GBM.
Manifestaciones clínicas
El inicio de la enfermedad asociada con la glomerulonefritis anti-GBM y el síndrome de Goodpasture puede estar precedido por una infección del tracto respiratorio superior. Esta infección, que generalmente afecta a las vías respiratorias altas, como la nasofaringe, puede actuar como un desencadenante de la respuesta inmune en individuos predispuestos a desarrollar estas patologías autoinmunitarias. Aunque el vínculo entre la infección y el inicio de la enfermedad no siempre es evidente, se ha observado que muchas veces la aparición de síntomas respiratorios iniciales, como tos, dolor de garganta o fiebre, precede a la manifestación clínica de la glomerulonefritis y la hemorragia pulmonar.
A medida que la enfermedad progresa, los pacientes pueden experimentar hemoptisis, que es la expectoración de sangre proveniente de las vías respiratorias inferiores, un signo distintivo de la afectación pulmonar. La hemoptisis es un hallazgo clínico común en el síndrome de Goodpasture y refleja la ruptura de los vasos sanguíneos en los pulmones debido al daño causado por los anticuerpos anti-GBM a las membranas basales alveolares. Además, la disnea, o dificultad para respirar, es otro síntoma frecuente, relacionado con la hemorragia pulmonar y la disminución de la capacidad de los pulmones para intercambiar gases de manera efectiva. En los casos graves, la hemorragia pulmonar puede progresar hacia insuficiencia respiratoria, que es una complicación crítica y potencialmente fatal si no se trata adecuadamente.
Los hallazgos renales, estos son típicos de una glomerulonefritis rápidamente progresiva (RPGN), una forma grave de glomerulonefritis que implica una rápida pérdida de la función renal. Los pacientes con RPGN presentan una rápida progresión hacia insuficiencia renal aguda, que se caracteriza por la presencia de semilunas en los glomérulos, una manifestación histológica importante en los análisis de biopsias renales. Este hallazgo está relacionado con la proliferación de células en la cápsula de Bowman, lo que genera un daño estructural significativo en los glomérulos y contribuye a la pérdida de la capacidad de filtración renal. Los síntomas clínicos comunes de la RPGN incluyen hematuria (presencia de sangre en la orina), proteinuria (proteínas en la orina) y, en muchos casos, un aumento en los niveles de creatinina sérica, lo que indica una función renal deteriorada.
Sin embargo, es importante señalar que no todos los casos de glomerulonefritis anti-GBM siguen el patrón clásico de RPGN severa. En algunos casos más raros, la enfermedad puede presentarse de manera más leve, dentro del espectro de la glomerulonefritis nefrítica, con hallazgos renales menos graves. En estos casos, los pacientes pueden experimentar hematuria glomerular (sangre en la orina proveniente de los glomérulos), proteinuria en cantidades moderadas, y un nivel mínimo de disfunción renal. Aunque estos casos son inusuales, subrayan la variabilidad en la presentación clínica de la enfermedad, lo que puede dificultar el diagnóstico temprano. En estas formas más leves, el daño renal puede no ser lo suficientemente grave como para causar insuficiencia renal aguda rápidamente, pero la progresión a largo plazo de la enfermedad puede llevar a un deterioro renal significativo si no se trata de manera adecuada.
Exámenes diagnósticos
Las radiografías de tórax pueden mostrar infiltrados pulmonares en presencia de hemorragia pulmonar, una manifestación común en el síndrome de Goodpasture, asociado con la glomerulonefritis anti-GBM. La hemorragia pulmonar ocurre cuando los anticuerpos anti-GBM atacan las membranas basales alveolares de los pulmones, lo que da lugar a la ruptura de los pequeños vasos sanguíneos y la liberación de sangre en los alveolos. Esta sangre se infiltra en el tejido pulmonar, lo que se refleja en la radiografía de tórax como áreas opacas o infiltradas. Los infiltrados pulmonares visibles en la imagen radiológica son indicativos de la presencia de sangre en los pulmones y sugieren una afectación clínica grave, lo que puede estar asociado con síntomas respiratorios, como hemoptisis (expectoración de sangre), disnea (dificultad para respirar) e insuficiencia respiratoria en los casos más avanzados.
En cuanto a los niveles de complemento en suero, estos suelen ser normales en los pacientes con enfermedad anti-GBM, lo cual es un hallazgo importante. A diferencia de otras formas de glomerulonefritis inmunológica, como las glomerulonefritis mediadas por complejos inmunes, donde los niveles de complemento suelen estar disminuidos debido a la activación del sistema del complemento, la glomerulonefritis anti-GBM no muestra una alteración significativa en los niveles séricos de complemento. Este hallazgo es relevante porque sugiere que el mecanismo patológico subyacente en la enfermedad anti-GBM es principalmente la formación de anticuerpos dirigidos contra la membrana basal glomerular, y no la formación de complejos inmunes que activan el complemento.
La presencia de anticuerpos anti-GBM circulantes es un hallazgo diagnóstico clave en esta enfermedad, y estos anticuerpos están presentes en más del 90% de los pacientes con glomerulonefritis anti-GBM. Estos anticuerpos se dirigen específicamente contra los epítopos del colágeno tipo IV, que es un componente esencial de la membrana basal glomerular y también está presente en la membrana basal alveolar. La detección de estos anticuerpos en el suero de los pacientes confirma la naturaleza autoinmunitaria de la enfermedad y es fundamental para el diagnóstico de la glomerulonefritis anti-GBM y el síndrome de Goodpasture. En raras ocasiones, algunos pacientes pueden presentar títulos elevados de anticuerpos anticitoplasma de neutrófilos (ANCA), lo que sugiere una posible superposición con otras formas de glomerulonefritis, como la glomerulonefritis asociada con vasculitis. Sin embargo, la presencia de ANCA elevados es menos común y no es un hallazgo diagnóstico fundamental en esta patología.
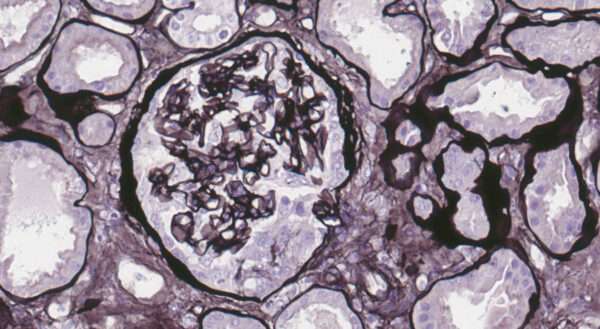
La biopsia renal es un paso esencial en el diagnóstico de la glomerulonefritis anti-GBM, ya que proporciona evidencia directa del daño glomerular. En la mayoría de los casos, el análisis de la biopsia renal muestra la formación de semilunas en los glomérulos, un hallazgo característico de la glomerulonefritis rápidamente progresiva. Las semilunas se forman debido a la proliferación de células en la cápsula de Bowman, una respuesta a la lesión glomerular severa que ocurre como resultado de la actividad inflamatoria mediada por los anticuerpos anti-GBM. La semiluna es una estructura patológica que se observa típicamente en las glomerulonefritis que cursan con rápida pérdida de función renal.
El estudio inmunofluorescente es crucial para confirmar el diagnóstico. En la glomerulonefritis anti-GBM, el análisis por inmunofluorescencia muestra una tinción lineal de inmunoglobulina G (IgG) a lo largo de la membrana basal glomerular. Esta tinción lineal es altamente característica y se debe a la unión de los anticuerpos anti-GBM a los epítopos específicos del colágeno tipo IV en la membrana basal. Este patrón de tinción es distinto de otras enfermedades glomerulares autoinmunitarias, como las glomerulonefritis asociadas con complejos inmunes, que suelen mostrar patrones más granulados o en «flecos» de tinción. La identificación de esta tinción lineal de IgG en la biopsia renal es un hallazgo diagnóstico fundamental que permite confirmar la presencia de anticuerpos anti-GBM y establecer el diagnóstico de glomerulonefritis anti-GBM.
Tratamiento
Los pacientes que presentan hemorragia pulmonar y una fuerte sospecha clínica de síndrome de Goodpasture deben ser tratados de manera urgente, a menudo incluso antes de que se confirme el diagnóstico mediante serología y biopsia renal. Esto se debe a la naturaleza potencialmente mortal de la enfermedad, que puede progresar rápidamente y provocar un daño irreversible tanto en los pulmones como en los riñones si no se inicia un tratamiento adecuado de forma temprana. La hemorragia pulmonar y la glomerulonefritis rápidamente progresiva son complicaciones graves que requieren intervención inmediata para evitar un desenlace fatal.
El tratamiento inicial se basa en una combinación de intercambios terapéuticos de plasma (plasmaféresis), corticosteroides y ciclofosfamida. La plasmaféresis se realiza de manera diaria durante un período de hasta dos semanas. Esta terapia tiene como objetivo eliminar los anticuerpos anti-GBM circulantes del plasma, ya que estos anticuerpos son los responsables del daño tanto a las membranas basales glomerulares en los riñones como a las membranas basales alveolares en los pulmones. Al reducir la cantidad de anticuerpos presentes en la circulación, se interrumpe la progresión de la lesión tisular. La plasmaféresis es particularmente crucial en las primeras etapas de la enfermedad, cuando los niveles de anticuerpos son más elevados y el daño puede ser más agudo.
Simultáneamente, se administran corticosteroides y ciclofosfamida. Los corticosteroides ayudan a suprimir la respuesta inflamatoria generalizada, lo que reduce la activación del sistema inmune y controla la inflamación que ocurre en los riñones y los pulmones. La ciclofosfamida, un agente inmunosupresor, es eficaz para prevenir la formación de nuevos anticuerpos anti-GBM, al inhibir la proliferación de las células B que son responsables de su producción. Este enfoque combinado ayuda a frenar tanto la formación de anticuerpos como la inflamación asociada, lo que reduce el daño a los órganos afectados.
En algunos casos, cuando la enfermedad es refractaria al tratamiento estándar o no responde adecuadamente a la plasmaféresis y la terapia inmunosupresora, se ha utilizado rituximab, un anticuerpo monoclonal que dirige específicamente las células B y puede ser útil para reducir la producción de anticuerpos en pacientes con enfermedad resistente. Sin embargo, el uso de rituximab en esta situación es limitado y se ha utilizado en un número pequeño de pacientes con enfermedad persistente o refractaria.
El pronóstico de los pacientes con síndrome de Goodpasture depende en gran medida de la rapidez con que se inicie el tratamiento y de la gravedad del daño renal y pulmonar al momento de la presentación. Los pacientes que presentan insuficiencia renal aguda oligurica, es decir, aquellos con una disminución muy marcada en la producción de orina, o aquellos que requieren diálisis al momento de la presentación, tienen un pronóstico mucho más reservado. La insuficiencia renal aguda grave, junto con hemorragia pulmonar significativa, indica una afectación más extensa de los órganos, lo que puede dificultar la respuesta al tratamiento y aumentar el riesgo de complicaciones a largo plazo.
A medida que el tratamiento progresa y la respuesta clínica mejora, los títulos de los anticuerpos anti-GBM deben disminuir. Esta reducción de los anticuerpos circulantes es un indicador positivo de que la terapia está siendo efectiva, ya que implica que el sistema inmunológico está perdiendo su capacidad para atacar las membranas basales. El monitoreo de estos títulos de anticuerpos es esencial para evaluar la eficacia del tratamiento y para ajustar las intervenciones según la evolución de la enfermedad.

Fuente y lecturas recomendadas:
- Kuang H et al. Autoimmunity in anti-glomerular basement membrane disease: mechanisms and prospects for immunotherapy. Am J Kidney Dis. 2023;81:90. [PMID: 36334986]
- Ponticelli C et al. Anti-glomerular basement membrane vasculitis. Autoimmun Rev. 2023;22:103212. [PMID: 36252931]
- Reggiani F et al. Goodpasture syndrome and antiglomerular basement membrane disease. Clin Exp Rheumatol. 2023;41:964. [PMID: 36995324]
Originally posted on 29 de marzo de 2025 @ 1:07 AM