Trichuris trichiura, conocido comúnmente como el gusano látigo, es un parásito intestinal cuyo ciclo de vida está estrechamente vinculado a condiciones ambientales específicas, lo que lo convierte en una de las infecciones más prevalentes en regiones tropicales y subtropicales del mundo, especialmente en áreas con alta humedad. Se estima que alrededor de 500 millones de personas a nivel global están infectadas por este nematodo, y la prevalencia es particularmente alta en niños, quienes son más susceptibles a contraer la infección debido a sus hábitos de juego y la mayor exposición a ambientes contaminados con los huevos del parásito.
La transmisión de Trichuris trichiura ocurre principalmente a través de la ingestión de sus huevos, que se encuentran presentes en suelos contaminados, alimentos o agua. Una vez que los huevos son ingeridos, pasan por el tracto digestivo y llegan al intestino delgado, donde eclosionan y liberan larvas que luego migran hacia el intestino grueso. En el colon, las larvas maduran hasta convertirse en gusanos adultos de aproximadamente 4 centímetros de longitud. Estos gusanos tienen una morfología característica, con una parte posterior del cuerpo delgada y en forma de látigo, lo que les da su nombre común.
Una vez que los gusanos alcanzan la madurez, se adhieren a la mucosa del intestino grueso, donde permanecen durante su ciclo de vida. A diferencia de otros parásitos intestinales, Trichuris trichiura no migra a través de los tejidos corporales ni se distribuye en otras partes del cuerpo, sino que se mantiene confinada al intestino grueso. Este parásito puede causar una variedad de síntomas clínicos, que van desde un cuadro asintomático hasta trastornos gastrointestinales más graves, como diarrea, dolor abdominal, y en casos más severos, prolapso rectal, especialmente en individuos con cargas parasitarias elevadas.
La enfermedad que provoca esta infección, conocida como tricuriasis, tiene una mayor incidencia en las zonas con condiciones de higiene deficiente, donde el ciclo de vida del parásito se facilita por la exposición constante a los huevos en el ambiente. Dado que los huevos pueden persistir en el suelo durante largos períodos, la prevención de la infección depende principalmente de medidas como el acceso a agua potable limpia, la mejora en las condiciones sanitarias y la educación sobre prácticas de higiene, especialmente en áreas rurales y empobrecidas donde la infección es más común.
Manifestaciones clínicas
La mayoría de las personas infectadas por Trichuris trichiura son asintomáticas, es decir, no presentan signos o síntomas evidentes de la infección. Esto se debe a que, en muchos casos, la cantidad de parásitos presentes en el intestino es baja o el sistema inmunológico del individuo logra controlar la proliferación del parásito de manera eficiente. Sin embargo, incluso cuando los síntomas no son evidentes, las personas infectadas pueden actuar como reservorios de la enfermedad, contribuyendo a la transmisión del parásito en su entorno, lo que perpetúa el ciclo de infección.
En aquellos casos donde la carga parasitaria es más alta, los síntomas pueden volverse más notorios. Las infecciones más severas por Trichuris trichiura suelen ir acompañadas de una variedad de molestias gastrointestinales, que incluyen cólicos abdominales, tenesmo (sensación de evacuación incompleta del intestino), diarrea, distensión abdominal, náuseas y vómitos. Estos síntomas son el resultado de la presencia de los gusanos adultos en el colon, donde se adhieren a la mucosa intestinal, provocando irritación y una respuesta inflamatoria local que altera el funcionamiento normal del tracto digestivo. La irritación puede generar dolor abdominal, mientras que la diarrea y la distensión abdominal son respuestas típicas del cuerpo a la alteración del equilibrio en la absorción de nutrientes y fluidos.
En casos más graves y especialmente en niños pequeños que padecen desnutrición, puede desarrollarse el síndrome conocido como disentería tricuriana. Este síndrome se caracteriza por una diarrea profusa y con sangre, junto con una inflamación significativa en la mucosa intestinal. En algunos casos, los niños pueden experimentar un prolapso rectal, es decir, una protrusión del recto a través del ano, lo cual es un signo clínico serio de que la infección está provocando un daño significativo en las estructuras intestinales. La disentería tricuriana se parece a enfermedades inflamatorias del intestino (como la enfermedad de Crohn o la colitis ulcerosa) en cuanto a los síntomas, lo que puede llevar a un diagnóstico diferencial complejo.
La aparición de estos síntomas graves, como la diarrea sanguinolenta y el prolapso rectal, ocurre más comúnmente en personas que están inmunológicamente debilitadas o malnutridas, debido a la combinación de una respuesta inmunitaria subóptima y la exposición prolongada al parásito. En estos casos, el parásito puede inducir una reacción inflamatoria más pronunciada en el colon, que resulta en un daño significativo a la mucosa intestinal. La desnutrición en particular puede aumentar la susceptibilidad a la infección y agravar los efectos de la misma, ya que el sistema inmunológico de los niños desnutridos es menos capaz de controlar la invasión parasitaria.
Por lo tanto, mientras que la mayoría de los individuos infectados por Trichuris trichiura no experimentan síntomas notables, aquellos con infecciones pesadas o que se encuentran en situaciones de vulnerabilidad, como los niños desnutridos, pueden enfrentar manifestaciones clínicas graves que afectan no solo su bienestar digestivo, sino también su salud general.
Exámenes diagnósticos
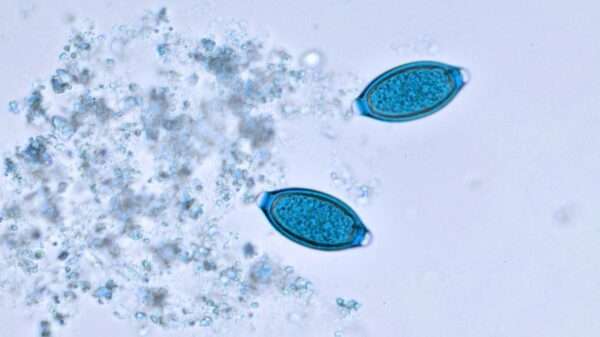
La tricuriasis se diagnostica principalmente a través de la identificación de los huevos característicos del parásito en las muestras de heces del paciente. Los huevos de Trichuris trichiura tienen una morfología distintiva que facilita su identificación bajo el microscopio. Estos huevos son alargados, con una forma de barril y tienen dos extremidades opacas que se asemejan a los polos de un huso, lo que los diferencia de los huevos de otros parásitos intestinales. La presencia de estos huevos en las heces, generalmente en grandes cantidades en los casos de infección severa, es el principal indicador diagnóstico de la infección.
En algunos casos, si la infección es lo suficientemente grave o prolongada, también pueden encontrarse gusanos adultos en las heces, aunque este hallazgo no es tan frecuente debido a que los gusanos suelen adherirse a la mucosa del intestino grueso y no son eliminados fácilmente con las evacuaciones. Los gusanos adultos, que alcanzan aproximadamente 4 centímetros de longitud, tienen una estructura corporal característica que les permite ser diferenciados de otros nematodos intestinales cuando se visualizan en muestras de heces.
Además de la identificación de los huevos o los gusanos adultos, el diagnóstico de tricuriasis puede ser complementado con la observación de ciertos cambios en los resultados de los análisis de sangre. Una de las alteraciones más comunes en las personas infectadas es la eosinofilia, un aumento en el número de eosinófilos, un tipo de glóbulo blanco. Los eosinófilos son células del sistema inmunológico que están involucradas en las respuestas alérgicas y en la defensa contra parásitos, por lo que su elevación es una respuesta típica ante la presencia de Trichuris trichiura. Aunque la eosinofilia no es específica para esta infección, su presencia, junto con los hallazgos de huevos característicos en las heces, puede proporcionar una pista importante en el diagnóstico.
El diagnóstico de tricuriasis se realiza, por tanto, mediante una combinación de la observación directa de los huevos o gusanos en las heces y la evaluación de los parámetros sanguíneos, particularmente la eosinofilia. En casos más complejos, cuando el cuadro clínico es severo y se presentan síntomas sistémicos, como la disentería o el prolapso rectal, se pueden realizar pruebas adicionales para descartar otras patologías intestinales o para evaluar el impacto del parásito en el organismo del paciente. Sin embargo, la identificación de los huevos en las heces sigue siendo el método más confiable y utilizado para el diagnóstico de esta parasitosis.
Tratamiento
El tratamiento de la tricuriasis generalmente se realiza con fármacos antiparasitarios como el albendazol o el mebendazol, los cuales son ampliamente utilizados para el control de las infecciones por nematodos intestinales. El albendazol se administra a una dosis de 400 miligramos por vía oral al día, mientras que el mebendazol se toma a 200 miligramos diarios, durante un período que varía según la gravedad de la infección. En casos de infecciones leves, el tratamiento suele durar entre 1 y 3 días, mientras que para infecciones más graves, la duración del tratamiento se extiende entre 3 y 7 días.
Sin embargo, a pesar de la eficacia comprobada de estos fármacos, las tasas de cura en la tricuriasis son generalmente más bajas en comparación con otras infecciones parasitarias como la ascariasis o la infección por anquilostomas. Esto se debe a varios factores, entre ellos la capacidad del parásito de adherirse firmemente a la mucosa intestinal, lo que dificulta su eliminación completa con tratamientos estándar. Además, en algunas zonas endémicas, las infecciones por Trichuris trichiura pueden ser resistentes a los tratamientos convencionales, lo que reduce aún más las tasas de éxito.
Como alternativa al albendazol y el mebendazol, se ha utilizado la ivermectina, que se administra a una dosis de 200 microgramos por kilogramo de peso corporal al día, durante 3 días consecutivos. Aunque la ivermectina es efectiva contra una variedad de parásitos, su eficacia específica para Trichuris trichiura ha mostrado resultados mixtos en diferentes estudios y regiones. En general, la ivermectina tiene un perfil de acción más enfocado a otros tipos de parásitos, como los filáridos, y su efectividad contra Trichuris trichiura puede ser inferior en comparación con otros fármacos.
Un fármaco relativamente más prometedor en el tratamiento de la tricuriasis es el oxantel pamoato. Este medicamento, administrado en una sola dosis de entre 15 y 30 miligramos por kilogramo de peso corporal, ha demostrado una buena eficacia en la eliminación de las infecciones por Trichuris trichiura. En ensayos clínicos aleatorizados, se observó que la combinación de albendazol con oxantel pamoato fue superior tanto al tratamiento con mebendazol como al tratamiento con albendazol solo. Específicamente, la combinación de albendazol y oxantel pamoato alcanzó una tasa de cura del 31% y una reducción del 96% en los huevos de Trichuris trichiura en las heces. La combinación de albendazol con oxantel pamoato mostró incluso mejores resultados, con una tasa de cura del 69% y una reducción del 99% de los huevos en comparación con albendazol y mebendazol. Por otro lado, la combinación de albendazol con ivermectina mostró una tasa de cura del 28% y una reducción del 95% en los huevos, lo que aún la hace menos efectiva en comparación con la combinación de albendazol y oxantel pamoato.
No obstante, es importante señalar que la eficacia del oxantel pamoato varía según la región geográfica, y en algunas áreas de alta prevalencia de Trichuris trichiura, los resultados han sido menos satisfactorios. Además, el oxantel pamoato tiene una eficacia limitada contra otras infecciones parasitarias comunes, como la ascariasis y la infección por anquilostomas, lo que restringe su uso como tratamiento universal.

Fuente y lecturas recomendadas:
- Goldman, L., & Schafer, A. I. (Eds.). (2020). Goldman-Cecil Medicine (26th ed.). Elsevier.
- Loscalzo, J., Fauci, A. S., Kasper, D. L., Hauser, S. L., Longo, D. L., & Jameson, J. L. (Eds.). (2022). Harrison. Principios de medicina interna (21.ª ed.). McGraw-Hill Education.
- Papadakis, M. A., McPhee, S. J., Rabow, M. W., & McQuaid, K. R. (Eds.). (2024). Diagnóstico clínico y tratamiento 2025. McGraw Hill.
- Rozman, C., & Cardellach López, F. (Eds.). (2024). Medicina interna (20.ª ed.). Elsevier España.