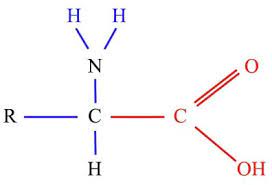
Los 20 aminoácidos que forman parte de las proteínas y están codificados en el ADN se clasifican según los grupos funcionales de su cadena lateral en:
-
- Aminoácidos alifáticos
- Aminoácidos que contienen azufre
- Iminoácido
- Aminoácidos neutros
- Aminoácidos ácidos
- Aminoácidos básicos
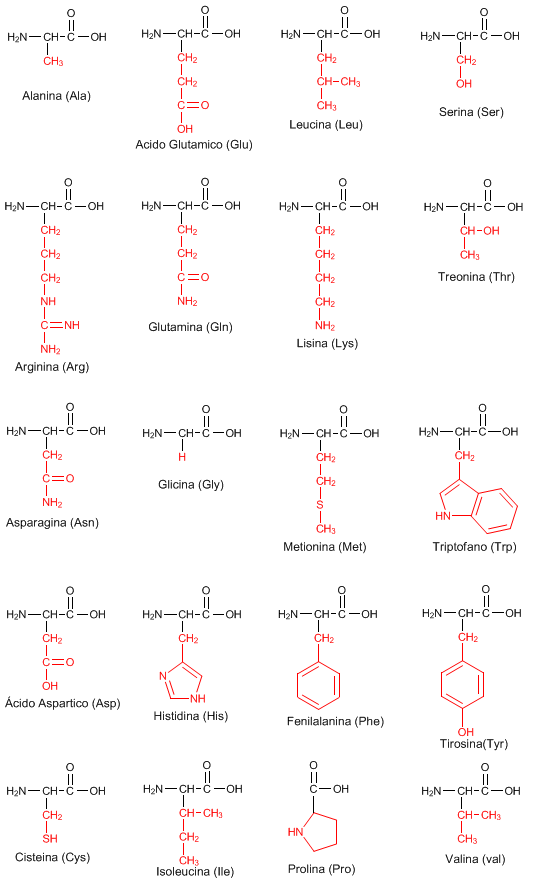
Clasificación de los aminoácidos
- Aminoácidos alifáticos
- Glicina
- Alanina
- Valina
- Leucina
- Isoleucina
- Aminoácidos que contienen azufre
- Cisterna
- Metionina
- Aminoácidos aromáticos
- Fenilalanina
- Tirosina
- Triptófano
- Iminoácido
- Prolina
- Aminoácidos neutros
- Serina
- Treonina
- Asparagina
- Glutamina
- Aminoácidos ácidos
- Ácido aspártico
- Ácido glutámico
- Aminoácidos básicos
- Histidina
- Lisina
- Arginina
Características de los tipos de aminoácidos
Los aminoácidos alifáticos tienen hidrocarbonos saturados como cadenas laterales. Todos estos aminoácidos son hidrofóbicos.
-
- alanina
- valina
- leucina
- isoleucina
- glicina
La glicina solamente tiene un hidrógeno como cadena lateral.
Los aminoácidos apolares alifáticos y aromáticos suelen encontrarse enterrados en el interior de la proteína.
-
- fenilalanina
- tirosina
- triptófano
Los aminoácidos polares neutros contienen grupos hidroxilo o amida en su cadena lateral.
-
- serina
- treonina
- asparagina
- glutamina
Los aminoácidos ácidos contienen ácidos carboxílicos en sus cadenas laterales y están ionizados a un pH de 7.0 y, como resultado, transportan cargas negativas en sus grupos carboxilo beta y gama.
-
- ácido aspártico
- ácido glutámico
Los aminoácidos básicos tienen cadenas laterales que están completamente protonadas a pH neutro y, por tanto, están cargadas positivamente:
-
- lisina
- arginina
- histidina
La metionina, la cisteína y su forma oxidada, la cistina, son aminoácidos que contienen azufre y que se caracterizan por su baja polaridad.
La prolina se diferencia del resto de aminoácidos en que el anillo de pirrolidina de su cadena lateral incluye el grupo alfa-amino y el carbono alfa.
Los aminoácidos son moléculas anfóteras, es decir, tienen tanto grupos básicos como ácidos.
La carga neta global de una proteína depende de la contribución de los aminoácidos básicos (carga positiva) y ácidos (carga negativa), pero la carga real en la proteína varía con el pH de la disolución.
Las cadenas laterales polares pueden intervenir en la unión del hidrógeno al agua y a otros grupos polares y normalmente se encuentran en la superficie de la proteína. Las cadenas laterales hidrofóbicas contribuyen al plegamiento de la proteína mediante interacciones hidrofóbicas y se encuentran principalmente en el interior de la proteína o en superficies que intervienen en interacciones con otras proteínas.