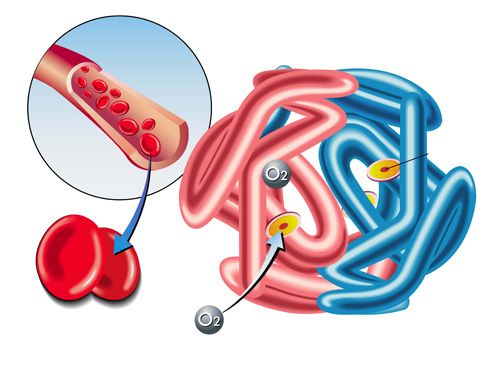
El organismo humano cuenta con un sistema circulatorio cerrado y un mecanismo para extraer O2 del aire y liberar dióxido de carbono como producto de desecho. El O2 inspirado permite un uso eficaz de los combustibles metabólicos, como la glucosa y los ácidos grasos. El CO2 espirado es un producto importante del metabolismo celular.
La mayor parte del oxígeno del organismo es transportado en la sangre y almacenado en el músculo en forma de un complejo con el hierro en las proteínas hemoglobina y mioglobina, respectivamente.
La hemoglobina es una proteína tetramérica que tiene 4 grupos hemo que son lugares de fijación para el oxígeno. La capacidad total de transportar oxígeno de la sangre arterial, en forma disuelta y fijada a proteínas, es de 8,8 mmol/l.
La hemoglobina humana es un ensamblaje tetramérico de 2 polipéptidos de α-globina de 141 residuos y un peso de 15.868 Daltons y 2 polipéptidos de ß-globina de 146 residuos y un peso de 15.126 Daltons.
En la hemoglobina un grupo prostético hemo se asocia de modo no covalente con cada apoproteína globina. Los aminoácidos polares se hallan casi exclusivamente en la superficie exterior de los polipéptidos de globina y contribuyen al elevado grado de solubilidad de estas proteínas.
El grupo hemo constituye un componente integral de las holoproteínas de globina durante la síntesis de los polipéptidos. El grupo hemo confiere a las globinas su color rojo-púrpura característico en estado desoxigenado en la sangre venosa y rojo en el estado oxigenado en la sangre arterial. Las globinas aumentan la solubilidad en agua del grupo prostético hemo, que de otro modo sería poco soluble e hidrofóbico.
La hemoglobina es la principal proteína transportadora de oxígeno de la sangre humana; se encuentra exclusivamente en los hematíes. La hemoglobina adulta (HbA) tiene una disposición tetraédrica de subunidades idénticas de α-globina y 2 subunidades idénticas de ß-globina, cada subunidad está en contacto con las otras tres.
En las interfases α-ß, de las subunidades de la hemoglobina existen múltiples interacciones no covalentes (enlaces de hidrógeno y electrostáticos).
La hemoglobina tiene que ser capaz de captar el oxígeno de forma eficaz al entrar en los alvéolos pulmonares durante la respiración y de liberarlo al entorno extracelular con una eficacia similar a medida que los eritrocitos circulan a través de los capilares tisulares.
Debido a cambios estructurales en la hemoglobina, como resultado de la fijación de oxígeno y de otros efectores, la afinidad para fijar las siguientes moléculas de oxígeno puede incrementarse (cooperación positiva) o disminuir (cooperación negativa). La cooperatividad en la fijación de oxígeno por la hemoglobina implica un desplazamiento entre dos estados conformacionales de la molécula de la hemoglobina que difieren en su afinidad por el oxígeno.
Las dos conformaciones cuaternarias de la hemoglobina se conocen como estados T (tenso) y R (relajado).
-
- En el estado T, las interacciones entre los heterodímeros son más fuertes.
- En el estado R, estos enlaces no covalentes son, en conjunto, más débiles.
✔ La afinidad por el oxígeno es más baja en el estado T y más alta en el estado R de la hemoglobina.