Las complicaciones neurológicas no metastásicas en el contexto de la enfermedad maligna se refieren a alteraciones del sistema nervioso que no son causadas por la invasión directa de células tumorales en el tejido cerebral o en otras estructuras del sistema nervioso. A pesar de que la metástasis cerebral es una complicación común de los cánceres, existen una serie de fenómenos neurológicos que pueden ocurrir en pacientes con enfermedades malignas que no están relacionados con la diseminación de células tumorales a través de la sangre.
Una de las principales causas de complicaciones neurológicas no metastásicas en los pacientes con cáncer es la reacción del sistema nervioso a las sustancias producidas por los tumores, los tratamientos empleados o la respuesta inflamatoria que generan. Estas complicaciones pueden surgir a través de diferentes mecanismos y se agrupan en varias categorías que incluyen trastornos metabólicos, alteraciones inmunológicas, efectos secundarios del tratamiento oncológico, y alteraciones en el flujo sanguíneo.
Encefalopatía
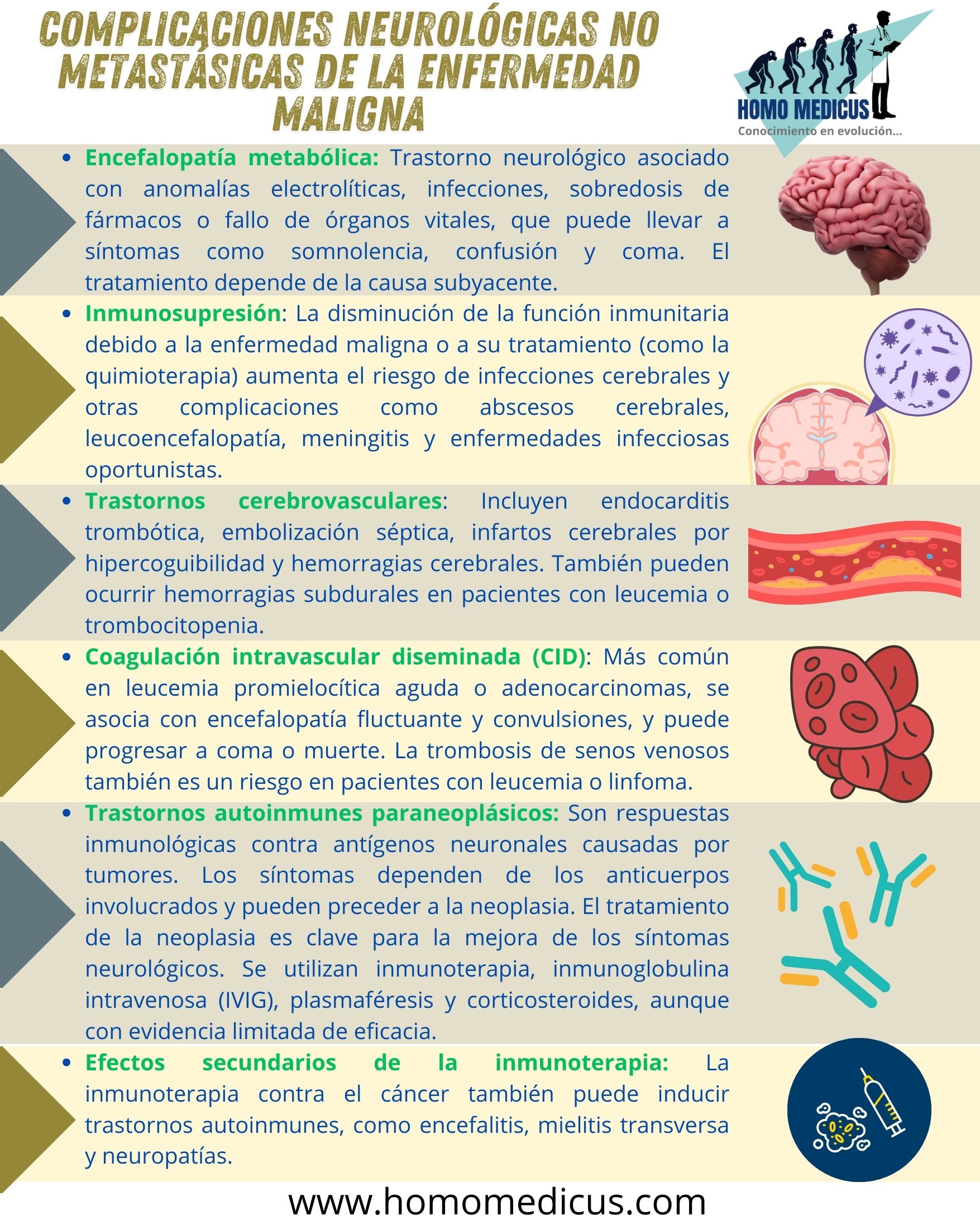
La encefalopatía metabólica es un trastorno del funcionamiento cerebral que puede ser desencadenado por diversas alteraciones metabólicas en el cuerpo, como anormalidades electrolíticas, infecciones, sobredosis de fármacos o el fallo de órganos vitales. Este tipo de encefalopatía es una manifestación de disfunción cerebral generalizada debido a la alteración de los procesos bioquímicos esenciales para la actividad neuronal.
Cuando ocurren alteraciones en los niveles de los electrolitos, como sodio, potasio, calcio o magnesio, o cuando el cuerpo experimenta infecciones severas o insuficiencia en órganos como el hígado o los riñones, los productos metabólicos tóxicos pueden acumularse en la sangre y afectar la función cerebral. De manera similar, la sobredosis de ciertos fármacos, como sedantes, analgésicos o quimioterapéuticos, puede alterar la homeostasis del organismo y generar un ambiente desfavorable para el correcto funcionamiento neuronal. Los órganos vitales son fundamentales para mantener el equilibrio interno del cuerpo, y cuando su función se ve comprometida, como en el caso de la insuficiencia hepática o renal, los productos tóxicos no se eliminan adecuadamente, lo que lleva a la acumulación de sustancias que pueden causar daño cerebral.
La encefalopatía metabólica suele manifestarse con una amplia variedad de síntomas neurológicos que reflejan la alteración de la actividad cerebral. Estos síntomas incluyen somnolencia, letargo, inquietud, insomnio, agitación, confusión, estupor o incluso coma, dependiendo de la gravedad del trastorno metabólico. Los pacientes pueden presentar alteraciones en el nivel de conciencia que van desde un estado de somnolencia o confusión leve hasta una alteración grave del nivel de alerta, como el coma. Los cambios mentales observados en la encefalopatía metabólica generalmente están acompañados por signos clínicos motores, como temblores, asterixis (un signo caracterizado por movimientos involuntarios y espasmódicos de las extremidades) y mioclono multifocal (contracciones musculares repentinas e involuntarias en diferentes áreas del cuerpo).
El electroencefalograma (EEG) es una herramienta diagnóstica importante en la evaluación de la encefalopatía metabólica. En estos casos, el EEG generalmente muestra una desaceleración difusa de la actividad eléctrica cerebral, lo que indica una disfunción generalizada de las redes neuronales. Esta desaceleración es un hallazgo característico en la encefalopatía metabólica, reflejando una alteración en la comunicación entre las diferentes regiones del cerebro debido al desequilibrio metabólico.
El diagnóstico de la encefalopatía metabólica requiere un enfoque integral y un conjunto de estudios de laboratorio para identificar la causa subyacente del trastorno. Los análisis de sangre pueden ser esenciales para detectar desequilibrios electrolíticos, como hiponatremia o hipocalcemia, o para evaluar la función hepática y renal, que pueden ser factores contribuyentes. Las pruebas adicionales, como la evaluación de la función respiratoria y cardiovascular, también pueden ser necesarias para descartar otras posibles causas de disfunción cerebral.
El tratamiento de la encefalopatía metabólica debe centrarse en corregir la causa subyacente del trastorno. Si la causa es una alteración electrolítica, el tratamiento se dirigirá a restaurar el equilibrio de los electrolitos a través de la administración de soluciones intravenosas o fármacos específicos. En casos de insuficiencia renal o hepática, la intervención médica podría incluir diálisis o tratamientos dirigidos a mejorar la función del órgano afectado. En situaciones de intoxicación por fármacos, es esencial administrar antídotos o discontinuar el uso de los fármacos responsables, si es posible.
Inmunosupresión
La supresión inmunológica, ya sea causada por la propia enfermedad maligna o por los tratamientos empleados para combatirla, como la quimioterapia, puede predisponer a los pacientes a una serie de infecciones graves, incluida la aparición de abscesos cerebrales, leucoencefalopatía multifocal progresiva, meningitis, infecciones por herpes zóster y otras enfermedades infecciosas oportunistas. El sistema inmunológico juega un papel fundamental en la defensa contra agentes patógenos, y cuando su función se ve comprometida, el cuerpo pierde la capacidad de prevenir la invasión de microorganismos, lo que aumenta el riesgo de infecciones en diversas localizaciones, incluido el cerebro.
La supresión inmunológica en los pacientes con cáncer puede ser un efecto directo de la enfermedad maligna misma. Algunos tipos de cáncer, como leucemias, linfomas o ciertos tumores sólidos, pueden interferir con la producción y función de las células inmunitarias, lo que resulta en un estado de inmunosupresión. Este compromiso en la respuesta inmune facilita la invasión de patógenos, lo que puede derivar en infecciones como abscesos cerebrales, en los cuales las bacterias o, en raras ocasiones, los hongos, causan una acumulación de pus en el cerebro. Las personas inmunocomprometidas también son más susceptibles a infecciones virales, como el herpes zóster, debido a la incapacidad de su sistema inmune para controlar adecuadamente los virus latentes en su organismo.
El tratamiento del cáncer, como la quimioterapia, también contribuye significativamente a la inmunosupresión. La quimioterapia no solo destruye las células tumorales, sino que también afecta a las células inmunitarias, como los linfocitos, lo que debilita la capacidad del cuerpo para defenderse contra infecciones. Además, algunos tratamientos dirigidos o la radioterapia pueden alterar la función de las células del sistema inmune, incrementando el riesgo de infecciones oportunistas, aquellas que se desarrollan cuando el sistema inmune está debilitado y los patógenos que normalmente no causarían enfermedad en personas saludables pueden proliferar.
Un factor adicional que puede aumentar el riesgo de infecciones en pacientes con enfermedades malignas es la presencia de una fístula de líquido cefalorraquídeo (LCR), que puede ser manifiesta o estar oculta en la mayoría de los casos. Una fístula de LCR es una comunicación anormal entre las cavidades del sistema ventricular del cerebro y el espacio subaracnoideo o con superficies externas del cerebro o la médula espinal. Estos orificios pueden ser causados por ciertos tipos de tumores, como los gliomas o los meningiomas, que afectan la integridad de las estructuras del sistema nervioso central. La fuga de LCR expone al cerebro y a las meninges a patógenos del entorno, lo que incrementa el riesgo de infecciones como la meningitis, ya que el líquido cefalorraquídeo es un medio óptimo para la proliferación de microorganismos.
En cuanto al diagnóstico de estas infecciones en pacientes inmunocomprometidos, las técnicas de imagen como la resonancia magnética (RM) o la tomografía computarizada (TC) son herramientas fundamentales para detectar y evaluar abscesos cerebrales, que se presentan como lesiones focales en las imágenes. Sin embargo, es importante destacar que los tumores cerebrales metastásicos, que son comunes en pacientes con cáncer, pueden presentar una apariencia similar en las imágenes, lo que hace necesario un análisis detallado de las características clínicas y de las imágenes para distinguir entre ambas condiciones. La resonancia magnética es particularmente útil debido a su capacidad para proporcionar imágenes detalladas de las estructuras cerebrales y detectar características específicas de los abscesos, como la formación de una cápsula alrededor de la lesión.
Por otro lado, cuando se sospecha de meningitis o encefalitis, el examen del líquido cefalorraquídeo es esencial para confirmar el diagnóstico. Este examen permite analizar las características del LCR, como el recuento celular, la concentración de proteínas y glucosa, y la presencia de microorganismos. En el caso de meningitis, el análisis del LCR puede revelar signos de infección, como un aumento en los leucocitos (pleocitosis), una disminución de la glucosa y un aumento de la proteína, lo que ayuda a identificar la causa de la infección. Sin embargo, es importante señalar que el examen del LCR no es útil en el diagnóstico de abscesos cerebrales, ya que estos no se manifiestan típicamente en los resultados del LCR, dado que la infección está contenida en una cavidad aislada dentro del cerebro.
Trastornos cerebrovasculares
Los trastornos cerebrovasculares son complicaciones comunes en pacientes con cáncer sistémico, y su aparición puede generar una serie de alteraciones neurológicas que afectan gravemente la calidad de vida y el pronóstico de los pacientes. Estas complicaciones cerebrovasculares pueden estar asociadas con diversos mecanismos, como la formación de coágulos sanguíneos, alteraciones en la coagulación, y la invasión de tumores metastásicos, entre otros. En este contexto, diversas condiciones específicas pueden ser responsables de los trastornos cerebrovasculares que afectan a los pacientes con cáncer, entre las que se incluyen la endocarditis trombótica no bacteriana, la embolización séptica, los infartos cerebrales asociados con hipercogulabilidad inducida por la malignidad, así como hemorragias cerebrales, subaracnoideas o subdurales, que pueden tener causas particulares en algunos tipos de cáncer.
Endocarditis trombótica no bacteriana y embolización séptica
La endocarditis trombótica no bacteriana es una condición que puede presentarse en pacientes con cáncer, especialmente aquellos con cáncer avanzado o en estadios terminales. Esta condición se caracteriza por la formación de trombos (coágulos sanguíneos) en las válvulas cardíacas o en las superficies endocárdicas, sin que haya infección bacteriana asociada. Estos trombos pueden desprenderse y viajar a través del torrente sanguíneo, lo que puede dar lugar a embolias en diversas partes del cuerpo, incluyendo el cerebro. La embolización séptica, que ocurre cuando los trombos están asociados con infecciones bacterianas en el corazón, también puede provocar embolias cerebrales, lo que a su vez lleva a la aparición de infartos cerebrales. Este tipo de complicaciones es particularmente prevalente en pacientes con cáncer que presentan un estado de inmunosupresión debido a la enfermedad o a los tratamientos, lo que facilita el desarrollo de infecciones y trombos.
Infartos cerebrales por hipercogulabilidad inducida por la malignidad
Los pacientes con cáncer son más propensos a desarrollar un estado de hipercogulabilidad, es decir, una tendencia aumentada a formar coágulos sanguíneos. Este fenómeno puede ser inducido tanto por la propia malignidad como por los tratamientos utilizados para combatirla. El cáncer, especialmente ciertos tipos como los adenocarcinomas, linfomas y leucemias, puede generar sustancias procoagulantes que alteran el equilibrio normal de la coagulación sanguínea, lo que favorece la formación de trombos. Estos trombos pueden obstruir las arterias cerebrales, provocando infartos cerebrales. La hipercogulabilidad también está estrechamente relacionada con el desarrollo de síndrome trombótico en pacientes con cáncer, lo que aumenta el riesgo de infartos cerebrales isquémicos y otras complicaciones relacionadas con la circulación sanguínea.
Hemorragias cerebrales, subaracnoideas y subdurales
Las hemorragias cerebrales, tanto en el parénquima cerebral como en los espacios subaracnoideo y subdural, son complicaciones frecuentes en algunos tipos de cáncer. En particular, los pacientes con leucemia mielógena, un tipo de leucemia que afecta la médula ósea, tienen un riesgo elevado de presentar hemorragias debido a la trombocitopenia, o disminución de plaquetas en sangre, que es un efecto secundario común de la enfermedad y de su tratamiento. Las plaquetas son esenciales para la coagulación sanguínea, y su disminución puede impedir la formación de coágulos en respuesta a lesiones, lo que facilita la aparición de hemorragias, tanto a nivel cerebral como en otras localizaciones. Las hemorragias cerebrales pueden variar en gravedad y afectar diversas áreas del cerebro, lo que puede resultar en deterioro neurológico.
Además, las hemorragias subaracnoideas (que ocurren en el espacio entre el cerebro y las membranas que lo recubren) y las hemorragias subdurales (que ocurren en el espacio entre la capa dura del cerebro y la aracnoides) también pueden estar asociadas con tumores metastásicos, como el melanoma. El melanoma es un tipo de cáncer de piel que tiene una alta tendencia a diseminarse a otros órganos, incluido el cerebro. En algunos casos, las metástasis cerebrales pueden debilitar los vasos sanguíneos en el cerebro, lo que aumenta el riesgo de hemorragias en las estructuras cerebrales y en los espacios pericraneales.
Hemorragia subdural espinal asociada con punción lumbar
La hemorragia subdural espinal es una complicación que puede ocurrir después de una punción lumbar en pacientes con trombocitopenia marcada, es decir, aquellos que tienen una cantidad muy baja de plaquetas en la sangre. La punción lumbar es un procedimiento comúnmente realizado para obtener muestras de líquido cefalorraquídeo o para la administración de medicamentos, pero en pacientes con trombocitopenia, el riesgo de hemorragia aumenta significativamente debido a la incapacidad de la sangre para coagular adecuadamente. La hemorragia subdural espinal, que ocurre en el espacio subdural de la columna vertebral, puede provocar dolor intenso, parálisis o disfunción neurológica dependiendo de la localización y la magnitud de la hemorragia. Esta condición es una complicación grave que requiere atención médica inmediata.
Coagulación intravascular diseminada
La coagulación intravascular diseminada (CID) es una condición patológica caracterizada por la activación masiva y anómala del sistema de coagulación sanguínea, lo que lleva a la formación de coágulos en pequeños vasos sanguíneos en todo el cuerpo. Esta activación puede agotar los factores de coagulación y las plaquetas, lo que aumenta el riesgo de hemorragias a medida que el organismo pierde la capacidad para regular de manera adecuada la coagulación. La CID se presenta más comúnmente en pacientes con leucemia promielocítica aguda y en algunos tipos de adenocarcinomas, condiciones en las que la malignidad promueve un estado procoagulante. La CID es una de las complicaciones más graves que afecta a estos pacientes, ya que puede inducir una serie de manifestaciones clínicas neurológicas de difícil manejo.
En el contexto de la leucemia promielocítica aguda, una forma de leucemia que afecta las células precursoras de los neutrófilos, la coagulación intravascular diseminada es una de las complicaciones más destacadas. La leucemia promielocítica aguda se asocia con la presencia de una anomalía genética, que provoca la liberación descontrolada de sustancias procoagulantes, lo que lleva a una activación aberrante de la coagulación. Este estado procoagulante aumenta el riesgo de formación de microtrombosis en diversos órganos, incluyendo el cerebro, lo que puede resultar en disfunción neurológica.
La encefalopatía fluctuante es uno de los hallazgos clínicos más característicos de la coagulación intravascular diseminada en estos pacientes. La encefalopatía, que se refiere a una alteración difusa de la función cerebral, puede variar en gravedad, desde una confusión leve hasta un estado de coma profundo. A menudo, los pacientes experimentan fluctuaciones en su nivel de conciencia, que pueden ser acompañadas de convulsiones. Las convulsiones son un signo común de la disfunción cerebral que se observa en el contexto de la CID, y estas pueden empeorar a medida que la enfermedad progresa, resultando en un deterioro rápido de las funciones cerebrales. La encefalopatía asociada con CID en pacientes con leucemia promielocítica aguda tiene una tendencia a progresar rápidamente hacia el coma y, en muchos casos, puede conducir a la muerte debido a la insuficiencia orgánica múltiple, las hemorragias o la disfunción cerebral severa.
Uno de los aspectos preocupantes de la encefalopatía asociada con la CID es que, a pesar de la gravedad de los síntomas neurológicos, pueden existir pocos signos neurológicos adicionales que ayuden en el diagnóstico. Esto se debe a que la patología subyacente se produce a nivel microscópico en los vasos sanguíneos cerebrales, y la manifestación clínica de la disfunción cerebral puede ser sutil y no necesariamente acompañada de otros hallazgos neurológicos como déficits focales o alteraciones motoras.
Además de la coagulación intravascular diseminada, otra complicación neurológica importante que se presenta en pacientes con leucemia o linfoma es la trombosis de los senos venosos cerebrales. Los senos venosos cerebrales son grandes venas que drenan la sangre del cerebro. La trombosis de estos senos, que es el bloqueo de estos vasos sanguíneos por la formación de coágulos, puede ocurrir en pacientes con trastornos hematológicos malignos, como la leucemia o el linfoma. La trombosis de los senos venosos cerebrales se presenta comúnmente con síntomas neurológicos como convulsiones y dolores de cabeza intensos, que son indicativos de la acumulación de presión intracraneal y la alteración del flujo sanguíneo cerebral.
En el examen físico y neurológico de pacientes con trombosis de los senos venosos, el hallazgo de papiledema, que es la inflamación del disco óptico, es frecuente. El papiledema es un signo de aumento de la presión intracraneal, y su presencia sugiere que el paciente está experimentando un trastorno grave del flujo sanguíneo cerebral. Además, los pacientes con trombosis de los senos venosos cerebrales pueden presentar signos neurológicos focales o difusos. Los signos focales indican daño localizado en áreas específicas del cerebro, lo que puede manifestarse como déficits motores, sensoriales o del lenguaje, mientras que los signos difusos pueden reflejar un compromiso generalizado de la función cerebral debido a la disminución del suministro sanguíneo a todo el cerebro.
La trombosis de los senos venosos cerebrales es una complicación grave y potencialmente mortal, y su manejo requiere una intervención rápida para restaurar el flujo sanguíneo cerebral y reducir el riesgo de daño cerebral irreversible. En general, el diagnóstico de estas complicaciones neurológicas se realiza mediante técnicas de imagen como la tomografía computarizada (TC) o la resonancia magnética (RM), que pueden mostrar la presencia de coágulos en los senos venosos cerebrales y ayudar a guiar el tratamiento.
Trastornos autoinmunes paraneoplásicos
Los trastornos autoinmunes paraneoplásicos son una serie de condiciones patológicas que ocurren cuando el sistema inmunológico, en respuesta a la presencia de un tumor maligno, ataca por error tejidos normales del cuerpo, particularmente el sistema nervioso. Este fenómeno sucede debido a que las células tumorales expresan antígenos neuronales, que son proteínas normalmente presentes en el sistema nervioso, pero que en este contexto son reconocidas como extrañas o anómalas por el sistema inmunológico. Como resultado, el cuerpo desarrolla una respuesta inmunitaria dirigida contra estos antígenos neuronales, lo que provoca una serie de trastornos neurológicos.
Las manifestaciones clínicas de los trastornos autoinmunes paraneoplásicos dependen en gran medida del tipo de autoanticuerpo presente. Estos autoanticuerpos son moléculas producidas por el sistema inmunológico que se dirigen contra componentes específicos de las células nerviosas. Los síntomas de estos trastornos pueden aparecer antes de la detección de la neoplasia subyacente, lo que puede dificultar el diagnóstico temprano de la enfermedad. La relación entre los trastornos neurológicos y el cáncer subyacente puede ser difícil de identificar, ya que los síntomas neurológicos a menudo no se asocian de inmediato con un cáncer, y el diagnóstico de un trastorno autoinmune paraneoplásico puede ser un desafío incluso cuando se sospecha la presencia de una neoplasia.
Existen diversos síndromes paraneoplásicos que son característicos de la respuesta autoinmune, cada uno asociado con anticuerpos específicos y con tipos de cáncer particulares. Por ejemplo, el síndrome de encefalitis paraneoplásica, a menudo relacionado con el cáncer de ovario, o la neuropatía sensitiva asociada con el carcinoma de pulmón. La identificación de un anticuerpo específico en sangre o en otros fluidos biológicos es fundamental para confirmar el diagnóstico, pero no siempre es posible detectar el anticuerpo causal en todas las presentaciones de trastornos autoinmunes paraneoplásicos. Esto se debe a la complejidad de la respuesta inmunológica y la variabilidad en la expresión de los autoanticuerpos, lo que puede llevar a la ausencia de un marcador detectable. En estos casos, es fundamental realizar una búsqueda exhaustiva del tumor subyacente, ya que la presencia del cáncer es clave para el manejo adecuado del trastorno.
El tratamiento de los trastornos autoinmunes paraneoplásicos se enfoca principalmente en tratar la neoplasia subyacente. La eliminación o control del tumor maligno ofrece la mejor oportunidad para la estabilización o, en algunos casos, para la mejora de los síntomas neurológicos, que en ocasiones no son completamente reversibles. La relación entre la respuesta inmune contra los antígenos neuronales y los síntomas neurológicos subyacentes implica que la resolución de la neoplasia puede reducir la estimulación inmune y, por ende, mejorar los trastornos autoinmunes asociados. Sin embargo, aunque el tratamiento oncológico es esencial, los trastornos neurológicos pueden persistir o incluso progresar, por lo que en muchos casos se deben utilizar enfoques terapéuticos adicionales para manejar los síntomas.
A pesar de que la base de los trastornos paraneoplásicos es la respuesta inmunológica, el tratamiento específico de los síntomas neurológicos mediado por los autoanticuerpos se lleva a cabo con el uso de terapias inmunosupresoras. La inmunoglobulina intravenosa (IVIG) y la plasmaféresis son dos de las estrategias terapéuticas más comúnmente utilizadas para tratar estos trastornos. La IVIG se administra con la esperanza de neutralizar los autoanticuerpos y reducir la inflamación neuronal, mientras que la plasmaféresis se utiliza para eliminar los anticuerpos circulantes del torrente sanguíneo. Los corticosteroides y otros regímenes inmunosupresores también se emplean para controlar la actividad inflamatoria y mitigar los efectos del ataque inmune contra los tejidos nerviosos. Sin embargo, es importante destacar que la evidencia de la eficacia de estas terapias es limitada, y su éxito puede ser variable, dependiendo del tipo de trastorno y del momento en que se inicie el tratamiento.
Algunos trastornos autoinmunes paraneoplásicos también pueden presentarse de forma aislada, es decir, sin la presencia de un tumor maligno evidente. En estos casos, el tratamiento con inmunoterapia, como los agentes inmunosupresores o la administración de anticuerpos monoclonales, suele ser más eficaz, y la respuesta a la inmunoterapia tiende a ser más favorable. Esto se debe a que la presencia del cáncer puede contribuir a la perpetuación de la respuesta inmune anómala, y la eliminación del tumor en estos casos puede ser menos relevante para la mejora de los síntomas neurológicos.
Es importante señalar que, además de los trastornos autoinmunes paraneoplásicos asociados con tumores malignos, también se ha observado que la inmunoterapia utilizada para tratar el cáncer puede desencadenar trastornos autoinmunes. Esto se ha evidenciado en pacientes que reciben terapias inmunológicas, como inhibidores de puntos de control inmunitarios, que aumentan la actividad del sistema inmunológico contra el cáncer, pero también pueden resultar en una activación autoinmune no deseada. En estos pacientes, se han descrito una serie de trastornos autoinmunes, tales como encefalitis, hipofisitis, meningitis, mielitis transversa, polineuropatía desmielinizante inflamatoria aguda y crónica, neuropatía autonómica, miastenia gravis y miositis. Estos trastornos pueden variar en gravedad y afectar diversos sistemas del cuerpo, incluyendo el sistema nervioso central y periférico.
Encefalitis asociada al receptor NMDA
Este trastorno se caracteriza por síntomas neuropsiquiátricos prominentes como paranoia, delirios, alteraciones del comportamiento, convulsiones, disquinesia orofacial, atetosis, disautonomía y, en casos graves, hipoventilación. Los anticuerpos involucrados en este trastorno son los dirigidos contra el receptor NMDA, y se asocian principalmente con teratomas ováricos, así como con tumores en los pulmones, mama, ovario y testículo.
Miopatía necrotizante autoinmune
Se caracteriza por debilidad muscular, que generalmente afecta a los músculos proximales. Los anticuerpos asociados incluyen los dirigidos contra la proteína de reconocimiento de la señal (SRP) y la 3-hidroxi-3-metilglutaril-coenzima A reductasa (HMGCR). Esta miopatía se vincula a menudo con cánceres de pulmón, mama, gastrointestinales y de vejiga.
Neuropatía autonómica
La neuropatía autonómica se manifiesta con síntomas como hipotensión postural, gastroparesia, y en ocasiones, disfunción autonómica más grave. Los anticuerpos comunes incluyen los dirigidos contra la proteína Hu y el receptor gangliónico de acetilcolina (AChR). Este trastorno se asocia con tumores en los pulmones, mama y otras localizaciones.
Degeneración cerebelosa
Los pacientes pueden presentar ataxia, disartria y nistagmo. Los anticuerpos más frecuentes incluyen los dirigidos contra la glutamato descarboxilasa (GAD65), el receptor metabotrópico de glutamato (mGluR1), entre otros. Este trastorno se observa a menudo en pacientes con cánceres de pulmón, mama, timo, ovario, testículo y linfoma de Hodgkin.
Dermatomiositis
La dermatomiositis se caracteriza por debilidad muscular y una erupción cutánea característica conocida como erupción heliotropo. El anticuerpo asociado más común es TIF-1 gamma. Este trastorno puede asociarse con cánceres de pulmón, mama, ovario, tracto gastrointestinal y linfoma.
Síndrome de Lambert-Eaton
El síndrome de Lambert-Eaton se presenta con debilidad muscular fatigable, ptosis, diplopía, sequedad bucal y estreñimiento. Los anticuerpos contra el canal de calcio dependiente de voltaje (VGCC) y SOX-1 son comunes en este síndrome, que se asocia principalmente con tumores pulmonares.
Encefalitis limbo-cerebral/encefalomielitis
Este trastorno se presenta con pérdida de memoria a corto plazo, alucinaciones, convulsiones, alteraciones del comportamiento y encefalopatía. Los anticuerpos involucrados incluyen aquellos contra el receptor AMPA, Caspr2, el colapsado mediador de respuesta de proteína 5 (CRMP5), el receptor GABA, GAD65, entre otros. Se asocia a cánceres de pulmón, mama, timo, ovario, testículo y linfoma de Hodgkin.
Miastenia gravis
Este trastorno neuromuscular se caracteriza por debilidad muscular fatigable, ptosis y diplopía. Los anticuerpos comúnmente encontrados son los dirigidos contra el receptor de acetilcolina (AChR), el LRP4 y el MuSK. Este trastorno se vincula principalmente con el timo.
Mielitis
La mielitis se manifiesta con paraparesia, disfunción de la vejiga y el intestino, y una alteración sensorial segmentaria. Los anticuerpos asociados incluyen aquellos contra la amphiphysin, el aquaporina 4 y el MOG (proteína oligodendrocítica de mielina). Este trastorno se asocia a menudo con tumores pulmonares, de mama, linfomas, leucemias, tiroides y riñón.
Opsoclonus/mio-clonus
Este trastorno se caracteriza por movimientos oculares erráticos, saccádicos conjugados y mioclonos en las extremidades. Los anticuerpos asociados incluyen los dirigidos contra Ri, y se asocia a menudo con tumores pulmonares, de mama, ovario, testículo y neuroblastoma en niños.
Retinopatía
La retinopatía paraneoplásica se presenta con pérdida de visión progresiva. Los anticuerpos asociados incluyen los dirigidos contra la recoverina y la célula bipolar retinal. Los tumores más comúnmente asociados son el cáncer de pulmón pequeño y el melanoma.
Neuropatía sensoriomotora
Este trastorno se presenta con entumecimiento, debilidad (si está presente), y puede ser crónico o agudo. Los anticuerpos asociados incluyen los dirigidos contra el Hu y la glicoproteína asociada a la mielina (MAG). Se observa con mayor frecuencia en pacientes con cáncer de pulmón de células pequeñas y gammopatías monoclonales.
Neuropatía sensorial
Los pacientes presentan dolor, entumecimiento, ataxia sensorial y, en algunos casos, pérdida auditiva. El anticuerpo comúnmente encontrado es el dirigido contra Hu. Este trastorno se asocia principalmente con cánceres de pulmón.
Síndrome de persona rígida
El síndrome de persona rígida se caracteriza por una contracción simultánea de los músculos antagonistas y agonistas, lo que provoca rigidez muscular progresiva. Los anticuerpos más comunes son los dirigidos contra amphiphysin, GAD65 y el receptor de glicina (GlyR). Este trastorno se vincula principalmente con cánceres de pulmón pequeño, mama, timo y linfomas.

Fuente y lecturas recomendadas:
- Graus F et al. Updated diagnostic criteria for paraneoplastic neurological syndromes. Neurol Neuroimmunol Neuroinflamm. 2021;8:e1014. [PMID: 34006622]
Originally posted on 6 de abril de 2025 @ 7:19 AM