Tipos de aminoácidos en las proteínas humanas
Los aminoácidos son compuestos orgánicos esenciales para la vida y forman la base de las proteínas. Son moléculas compuestas por carbono, hidrógeno, oxígeno y nitrógeno, y en algunos casos, también contienen azufre. Los aminoácidos son los bloques de construcción fundamentales de las proteínas, que son macromoléculas esenciales para la estructura y función de las células.
Existen 20 aminoácidos que son comúnmente encontrados en las proteínas del cuerpo humano. Estos aminoácidos se clasifican en dos categorías principales:
- Aminoácidos Esenciales: El cuerpo no puede sintetizar estos aminoácidos por sí mismo, por lo que deben obtenerse a través de la dieta. Incluyen histidina, isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptófano y valina.
- Aminoácidos No Esenciales: El cuerpo puede sintetizar estos aminoácidos a partir de otras fuentes y no es necesario obtenerlos directamente de la dieta. Incluyen alanina, arginina, asparagina, ácido aspártico, cisteína, glutamina, ácido glutámico, glicina, prolina, serina y tirosina.
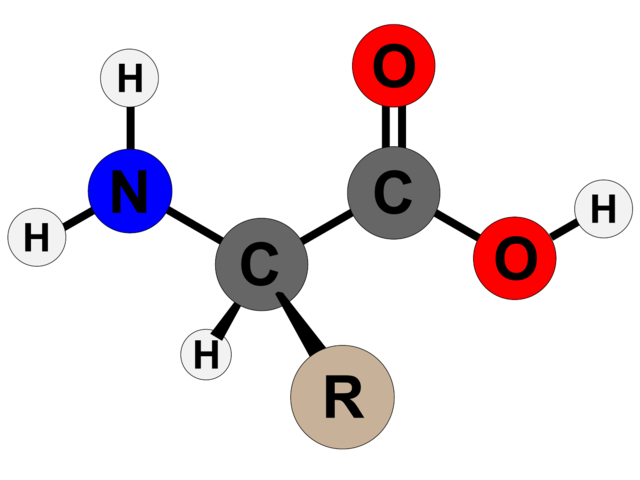
La estructura básica de un aminoácido consta de un grupo amino (-NH2), un grupo carboxilo (-COOH), un átomo de hidrógeno y una cadena lateral que varía entre los diferentes tipos de aminoácidos. La cadena lateral, también llamada “grupo R”, es única para cada aminoácido y le confiere propiedades químicas específicas.
La unión de aminoácidos mediante enlaces peptídicos da lugar a la formación de cadenas lineales llamadas polipéptidos, que, cuando se pliegan en una estructura tridimensional específica, constituyen proteínas. Las proteínas son cruciales para una variedad de funciones biológicas, incluyendo el soporte estructural, el transporte de sustancias, la función enzimática, la regulación del sistema inmunológico y muchas más.
Tipos de aminoácidos en las proteínas humanas
Los aminoácidos incorporados en las proteínas de mamíferos incluyendo a los humanos son “α”-aminoácidos. Por definición, tienen un grupo carboxilo-carbono y un grupo amino N ligado a un carbón-α central.
Los aminoácidos difieren en estructura por la sustitución de unos de los dos hidrógenos (N) en el carbón-α con otro grupo funcional.
Los aminoácidos pueden ser caracterizados por sus grupos funcionales, los cuales generalmente se organizan con pH neutro en las clases de grupos (a) no polar, (b) sin carga pero polar, (c) ácido (carga negativa), y (d) básico (carga positiva).
Dentro de cada clase hay diferencias considerables en tamaño y propiedades físicas. Los aminoácidos generalmente se agrupan en otros
subgrupos funcionales. Los aminoácidos con un grupo aromático – felanina, tirosina, triptófano, histidina – usualmente se los asocia, aunque la tirosina es claramente polar y la histidina también es básica. Otros agrupamientos comunes son los aminoácidos alifáticos o neutros (glicina, alanina, isoleucina, leucina, valina, serina, treonina, y prolina). La prolina difiere en que su grupo funcional también está ligado al grupo amino, formando así un anillo de cinco miembros. Debido al anillo, la prolina es en realidad un iminoácido, no un aminoácido.
La serina y treonina contienen grupos hidroxilos. También hay otro subgrupo importante: los aminoácidos de cadenas ramificadas (isoleucina, leucina y valina), que comparten enzimas comunes en los primeros dos pasos de su degradación. Estos aminoácidos acídicos, ácido aspártico y glutamínico, se refieren usual-mente a sus formas de sal ionizada: aspartato y glutamato. Estos aminoácidos se convierten en aspargina y glutamina cuando se adhiere un grupo amino en la forma de grupo amida a sus terminaciones carboxilo.

Tipos de aminoácidos en las proteínas humanas
Los aminoácidos que contienen azufre son la metionina y cisteína. La cisteína se encuentra usualmente en el cuerpo como un dímero llamado cistina en la cual los grupos tiol (los dos átomos de azufre) se conectan para formar una unión disulfuro.
Otros aminoácidos que contienen azufre, como la homocisteína, no están incorporados en la proteína.
Todos los aminoácidos existen como partículas cargadas en una solución: en agua, el grupo carboxilo pierde rápidamente un hidrógeno para formar un anión carboxilo (cargado negativamente), mientras que el grupo amino gana un hidrógeno cargado positivamente. Los aminoácidos se convierten entonces en “bipolar” (usualmente llamados zwitterion) en solución, pero sin una carga neta (las cargas positivas y negativas se cancelan). El grupo funcional adherido puede, sin embargo, distorsionar ese equilibrio.
- Los aminoácidos acídicos pierden el hidrógeno en el segundo grupo
carboxilo y se vuelven negativamente cargados en solución. - Los aminoácidos de grupo básico aceptan en parte un hidrógeno en el segundo N y forman una molécula con una carga neta positiva.
- Otros aminoácidos no aceptan ni donan específicamente hidrógenos adicionales en solución neutra, por lo que sus grupos funcionales influyen la polaridad relativa y la naturaleza basada en ácido de la porción bipolar de los aminoácidos y dan a cada aminoácido diferentes propiedades en la solución.
 Síguenos en X: @el_homomedicus y @enarm_intensivo
APRENDER CIRUGÍA
Síguenos en X: @el_homomedicus y @enarm_intensivo
APRENDER CIRUGÍA


















