El adenocarcinoma gástrico representa una de las principales causas de mortalidad por cáncer a nivel global, ubicándose como la tercera causa más común de muerte por esta enfermedad. Esta posición se explica por la combinación compleja de factores biológicos, ambientales y sociales que influyen en su aparición y desarrollo, así como por las características epidemiológicas particulares de la patología.
Uno de los elementos clave que contribuyen a la elevada mortalidad asociada a este tipo de cáncer es la influencia de diversos factores de riesgo que actúan de manera sinérgica. La edad avanzada se reconoce como un factor determinante, dado que la acumulación de daños genéticos y epigenéticos a lo largo del tiempo favorece la transformación maligna de las células gástricas. El sexo masculino presenta una predisposición mayor, probablemente relacionada con diferencias hormonales y patrones de exposición ambiental y de comportamiento, como el consumo de tabaco. Además, la raza no blanca, especialmente en poblaciones asiáticas y latinoamericanas, presenta una incidencia y mortalidad elevadas, posiblemente vinculadas tanto a predisposiciones genéticas como a condiciones socioeconómicas que modulan la exposición a carcinógenos y acceso a diagnóstico y tratamiento oportunos.
Entre los factores etiológicos, la infección por Helicobacter pylori ocupa un lugar preponderante. Esta bacteria induce una gastritis crónica que, mediante un proceso inflamatorio sostenido y la consiguiente alteración del epitelio gástrico, aumenta el riesgo de desarrollar adenocarcinoma entre tres y veinte veces en comparación con individuos no infectados. La persistencia de la inflamación crónica facilita la aparición de metaplasia intestinal, displasia y finalmente carcinoma, estableciendo un modelo bien caracterizado de carcinogénesis gástrica.
Históricamente, la incidencia del adenocarcinoma gástrico ha experimentado una disminución constante en las últimas siete décadas, especialmente en los países occidentales. Este fenómeno epidemiológico se atribuye a modificaciones en la alimentación, donde un mayor consumo de frutas y verduras, ricas en antioxidantes y vitaminas, contrarresta los efectos nocivos de compuestos potencialmente carcinogénicos. Asimismo, la generalización del uso de refrigeración para la conservación de alimentos ha reducido la necesidad de métodos tradicionales de preservación, como el salado o ahumado, asociados a la formación de nitrosaminas, reconocidas sustancias cancerígenas. A esto se suma la reducción en la prevalencia de infecciones por H. pylori, derivada de mejoras en saneamiento y acceso a tratamientos antibióticos. La menor exposición a contaminantes ambientales tóxicos también contribuye a esta tendencia favorable.
No obstante, la carga del cáncer gástrico persiste elevada en regiones específicas, como Japón, donde la prevalencia de la infección por H. pylori sigue siendo alta, y en diversas zonas en desarrollo, incluyendo partes de Asia oriental, Europa del Este, y países de América Latina como Chile, Colombia y América Central. En estos contextos, las condiciones socioeconómicas, dietéticas y sanitarias mantienen una exposición continua a los factores de riesgo.
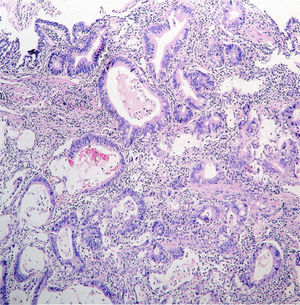
Desde el punto de vista histológico, el adenocarcinoma gástrico se clasifica fundamentalmente en dos tipos principales: el tipo intestinal y el tipo difuso. El primero se caracteriza por la formación de estructuras glandulares que recuerdan al tejido intestinal, reflejando un proceso de metaplasia intestinal previo. Este tipo representa entre el setenta y ochenta por ciento de los casos, siendo más frecuente en hombres y personas de edad avanzada, con una edad promedio de diagnóstico alrededor de los sesenta y ocho años. La asociación con H. pylori es particularmente fuerte, y se estima que entre el sesenta y noventa por ciento de estos tumores están vinculados a esta infección. Adicionalmente, condiciones como la anemia perniciosa, antecedentes de resección gástrica parcial de larga data, hábitos tabáquicos y dietas ricas en nitratos o sal, pero pobres en vitamina C, incrementan el riesgo para esta variante.
Por otro lado, el adenocarcinoma gástrico difuso representa aproximadamente entre el veinte y treinta por ciento de los casos. Este tipo se distingue por una pobre diferenciación celular y la ausencia de estructuras glandulares definidas, mostrando células dispersas que infiltren ampliamente la pared gástrica. A diferencia del tipo intestinal, afecta a hombres y mujeres por igual y se presenta con mayor frecuencia en individuos más jóvenes. Su relación con H. pylori es menos clara, y posee un pronóstico más desfavorable debido a su tendencia a metastatizar tempranamente. Se ha demostrado que el cáncer difuso está asociado a mutaciones patogénicas, tanto adquiridas como hereditarias, en genes que regulan la adhesión celular, principalmente la E-cadherina. En casos hereditarios, este tipo puede manifestarse tempranamente, con múltiples focos tumorales, infiltración difusa, y una histología característica de células en anillo de sello, lo que dificulta su manejo y empeora la supervivencia.
La mayoría de los adenocarcinomas gástricos se originan en el cuerpo y el antro del estómago, presentándose con morfologías variadas. Pueden formar masas polipoides o fungantes que protruyen hacia la luz gástrica, o bien lesiones ulceradas con bordes irregulares. En algunos casos, el tumor se disemina de forma difusa a través de la submucosa, provocando un engrosamiento rígido de la pared gástrica conocido como linitis plástica, caracterizado por un estómago endurecido y con pliegues engrosados, situación que se asocia con un pronóstico extremadamente pobre. Por último, existe el carcinoma gástrico superficial o temprano, que se limita a la mucosa o submucosa, con o sin compromiso ganglionar, y que se relaciona con mejores tasas de supervivencia debido a la posibilidad de intervención quirúrgica o endoscópica en etapas iniciales.
En las últimas décadas, mientras que la incidencia del cáncer en las regiones distales del estómago ha disminuido notablemente, se ha observado un aumento en la frecuencia de tumores localizados en el cardias gástrico, la zona que conecta el estómago con el esófago. Estos tumores muestran características epidemiológicas y patológicas similares a los adenocarcinomas esofágicos relacionados con la esófago de Barrett, una condición precursora vinculada al reflujo gastroesofágico crónico, lo que sugiere diferentes mecanismos etiopatogénicos en comparación con los cánceres gástricos distales tradicionales.
Manifestaciones clínicas
El carcinoma gástrico, debido a su naturaleza insidiosa y progresiva, suele permanecer clínicamente silencioso durante las etapas iniciales de su desarrollo, lo que dificulta enormemente su detección precoz. La ausencia de síntomas específicos en las fases tempranas se debe a que las lesiones malignas inicialmente no alteran significativamente la función gástrica ni causan molestias manifiestas, permitiendo que el tumor avance sin ser identificado. Cuando finalmente se manifiestan síntomas, estos tienden a ser inespecíficos y variables, influenciados en gran medida por la localización anatómica del tumor dentro del estómago.
Entre los signos clínicos más comunes se encuentran la dispepsia, caracterizada por una sensación difusa de malestar o dolor leve en la región epigástrica, que puede ser confundida con molestias gastrointestinales benignas o funcionales. Este dolor suele ser vago y mal localizado, lo que dificulta su asociación inmediata con una neoplasia. La anorexia, o pérdida del apetito, junto con la sensación temprana de saciedad después de ingerir pequeñas cantidades de alimento, reflejan una alteración progresiva de la capacidad gástrica funcional. Estos síntomas, asociados a una pérdida de peso no intencionada, representan señales importantes que pueden sugerir la presencia de un proceso patológico subyacente, aunque en muchos casos son atribuidos inicialmente a trastornos gastrointestinales benignos.
Además, la naturaleza inespecífica de estos síntomas lleva a que muchos pacientes busquen alivio mediante medicamentos de venta libre, como antiácidos o inhibidores de la acidez, los cuales pueden ofrecer una mejoría temporal de las molestias. Esta respuesta paliativa inicial contribuye a un retraso en la consulta médica especializada y, por ende, en el diagnóstico definitivo de la enfermedad.
En casos donde el tumor genera lesiones ulceradas, es común la aparición de sangrado gastrointestinal agudo, que se manifiesta clínicamente mediante hematemesis, es decir, la expulsión de sangre a través del vómito, o melena, que consiste en la presencia de heces negras y pegajosas debido a la digestión de la sangre. Estos episodios de hemorragia son señales de alarma que habitualmente llevan al paciente a buscar atención médica urgente.
Cuando el carcinoma se localiza en la región del píloro, el estrechamiento progresivo de la luz gástrica puede ocasionar una obstrucción que impide el paso normal del contenido alimenticio hacia el duodeno. Este fenómeno produce vómitos que ocurren después de las comidas, debido a la incapacidad del estómago para vaciarse adecuadamente. Por otro lado, la afectación del esfínter esofágico inferior o de la porción distal del esófago puede ocasionar una obstrucción progresiva que se traduce en disfagia, la dificultad para tragar alimentos, la cual suele agravarse con el tiempo y dificulta la ingesta oral.
En cuanto a la exploración física, esta rara vez aporta hallazgos concluyentes en las etapas iniciales o incluso en fases avanzadas del carcinoma gástrico. La palpación abdominal puede ser poco reveladora, ya que los tumores pueden no ser fácilmente detectables, y los signos clínicos generales, como la presencia de masa palpable o adenopatías, suelen manifestarse en fases muy tardías. Esto contribuye a que el diagnóstico se base fundamentalmente en técnicas de imagen, endoscopia y biopsias para la confirmación histológica.
Exámenes diagnósticos
La anemia por deficiencia de hierro, resultante de pérdidas sanguíneas crónicas, es una manifestación común en pacientes con carcinoma gástrico, reflejando la presencia de hemorragias digestivas insidiosas que pueden no ser evidentes clínicamente. Esta anemia también puede presentarse en el contexto de la anemia de la enfermedad crónica, un síndrome caracterizado por la alteración en la producción y utilización del hierro debido a procesos inflamatorios prolongados, como ocurre en la presencia de un tumor maligno. En la evaluación inicial, las pruebas de heces para detectar sangre oculta pueden arrojar resultados positivos, evidenciando sangrados microscópicos persistentes que contribuyen a la pérdida progresiva de hierro y al desarrollo de anemia.
En cuanto a los biomarcadores tumorales circulantes, aunque se han investigado múltiples sustancias para su potencial uso en el cribado o diagnóstico del cáncer gástrico, ninguno ha demostrado una validez clínica suficientemente establecida para ser incorporado como herramienta diagnóstica estándar. La heterogeneidad biológica del tumor y la baja sensibilidad y especificidad de estos marcadores limitan su utilidad práctica, por lo que el diagnóstico debe apoyarse en métodos más directos y precisos.
La endoscopia superior constituye un pilar fundamental en la evaluación de pacientes con síntomas gástricos. Se recomienda realizarla especialmente en individuos mayores de sesenta años que presenten síntomas recientes de dispepsia o molestias epigástricas, así como en pacientes más jóvenes que manifiesten signos de alarma tales como disfagia, vómitos recurrentes o pérdida de peso significativa. Esta indicación se enfatiza en pacientes provenientes de regiones geográficas con alta incidencia de cáncer gástrico, debido al mayor riesgo asociado. La endoscopia permite la visualización directa del mucosa gástrico y la obtención de biopsias de las lesiones sospechosas, lo que ofrece una alta sensibilidad para la detección del carcinoma. No obstante, en los casos de carcinoma gástrico difuso, caracterizado por una infiltración celular dispersa y ausencia de masas definidas, puede resultar difícil obtener muestras biopsicas representativas y suficientes para un diagnóstico certero.
Una vez confirmado el diagnóstico de carcinoma gástrico, es esencial llevar a cabo una evaluación preoperatoria completa para determinar la extensión local y sistémica de la enfermedad. La tomografía computarizada con contraste del tórax, abdomen y pelvis es el método estándar para identificar metástasis nodales o a distancia. Sin embargo, la ecografía endoscópica ofrece una superioridad notable en la valoración de la profundidad de invasión tumoral en la pared gástrica, información crucial para definir la resecabilidad y el tipo de tratamiento. Además, la ecografía endoscópica resulta especialmente útil en la evaluación de carcinomas gástricos en etapas tempranas, dado que permite identificar tumores que podrían ser tratados mediante resección mucosa endoscópica, una técnica menos invasiva y con mejores resultados funcionales.
Para la detección de metástasis distantes que podrían pasar desapercibidas en estudios convencionales, se recomienda el uso de imágenes funcionales como la tomografía por emisión de positrones o su combinación con tomografía computarizada (PET-CT). Estas modalidades brindan información metabólica y anatómica simultáneamente, mejorando la precisión en la estadificación del tumor y facilitando la planificación terapéutica adecuada.
Detección
La elevada prevalencia de carcinoma gástrico en países del este asiático, como Corea del Sur y Japón, ha motivado la implementación de programas de detección poblacional masiva mediante endoscopía superior. Estos programas nacionales de cribado buscan identificar lesiones neoplásicas en etapas tempranas, cuando el pronóstico es más favorable y las opciones terapéuticas menos invasivas pueden ser aplicadas con éxito. La decisión de establecer estas estrategias de detección se fundamenta en la alta incidencia regional de esta neoplasia, que justifica los costos y recursos asociados a la realización sistemática de endoscopías en la población general de edad avanzada.
Por el contrario, en países como los Estados Unidos, donde la incidencia del cáncer gástrico es considerablemente menor, la realización rutinaria de pruebas de detección no está recomendada para la población general debido a la baja prevalencia de la enfermedad, el bajo rendimiento en términos de detección temprana y las dudas sobre la relación costo-beneficio. No obstante, en ciertos grupos con mayor riesgo, como inmigrantes de primera generación provenientes de regiones con alta incidencia de carcinoma gástrico o individuos pertenecientes a grupos raciales o étnicos con predisposición incrementada, puede considerarse la evaluación endoscópica a partir de los cincuenta años. Esta recomendación selectiva responde a la necesidad de equilibrar la eficiencia del cribado con la realidad epidemiológica y los recursos sanitarios disponibles.
En relación con la infección por Helicobacter pylori, reconocida como un factor de riesgo primordial para el desarrollo de carcinoma gástrico, la estrategia de detección y erradicación en individuos asintomáticos presenta controversias. En Estados Unidos, debido a la ausencia de evidencia concluyente que respalde su eficacia y costo-efectividad en la prevención del cáncer gástrico a nivel poblacional, no se recomienda el tamizaje ni el tratamiento sistemático de H. pylorien adultos sin síntomas. Sin embargo, se aconseja la búsqueda activa y el tratamiento en pacientes que provienen de zonas con alta incidencia de carcinoma gástrico o que cuentan con antecedentes familiares de esta enfermedad, donde la probabilidad de beneficio es mayor.
Recientemente, un estudio retrospectivo realizado en 2023, que incluyó a más de setecientos mil pacientes con infección por H. pylori en una población comunitaria, aportó evidencia significativa acerca de la reducción del riesgo de adenocarcinoma gástrico tras el tratamiento antibiótico. Los resultados mostraron que, después de ocho años de seguimiento, aquellos individuos que recibieron terapia para erradicar la infección presentaron una disminución notable en la incidencia del carcinoma gástrico, con una razón de riesgo de 0.37 en comparación con los no tratados. Este hallazgo sugiere que, a pesar de la falta de recomendaciones universales para el tratamiento de H. pylori en población asintomática, la erradicación podría tener un impacto preventivo sustancial en el desarrollo de neoplasias gástricas, especialmente en contextos de alto riesgo, lo que podría orientar futuras políticas de salud pública.
Estadificación
La estadificación del adenocarcinoma gástrico constituye un proceso fundamental para definir el pronóstico y orientar el manejo terapéutico de los pacientes afectados. Para ello, se emplea el sistema TNM, una clasificación ampliamente reconocida que evalúa tres aspectos esenciales: la extensión local del tumor (T), la afectación de los ganglios linfáticos regionales (N) y la presencia de metástasis a distancia (M). Este sistema tiene una correlación directa y robusta con la supervivencia a largo plazo del paciente, permitiendo establecer un pronóstico más preciso y seleccionar aquellos candidatos que podrían beneficiarse de tratamientos adyuvantes o neoadyuvantes.
El análisis patológico del tumor debe ser exhaustivo y contemplar múltiples características que reflejan la biología y agresividad del cáncer. En primer lugar, es indispensable determinar el grado histológico, que indica el nivel de diferenciación celular y permite inferir la velocidad probable de crecimiento y diseminación tumoral. Un tumor bien diferenciado suele tener un comportamiento más indolente, mientras que un tumor pobremente diferenciado se asocia a mayor agresividad y peor pronóstico.
Asimismo, es crucial identificar el subtipo histológico del adenocarcinoma, ya que existen variantes con comportamientos clínicos y pronósticos distintos, como el tipo intestinal y el difuso, cada uno con particularidades en su patrón de crecimiento y respuesta al tratamiento.
La profundidad de invasión tumoral en la pared gástrica constituye otro parámetro indispensable, ya que influye directamente en la posibilidad de compromiso linfático y diseminación sistémica. Tumores que invaden capas profundas o estructuras adyacentes generalmente presentan un riesgo mayor de metástasis y requieren abordajes terapéuticos más agresivos.
La presencia de invasión linfática o vascular, detectada mediante el examen microscópico, es un indicador adicional de capacidad metastásica, evidenciando que las células tumorales han adquirido la habilidad de diseminarse a través de los vasos linfáticos o sanguíneos, lo cual afecta la estadificación y el pronóstico.
En casos en los que se confirme la existencia de enfermedad metastásica, se torna imprescindible evaluar la expresión de biomarcadores moleculares específicos que pueden condicionar el tratamiento personalizado. Entre ellos, la sobreexpresión o amplificación del receptor 2 del factor de crecimiento epidérmico humano, conocido como HER2, se determina mediante técnicas como la inmunohistoquímica y la hibridación fluorescente in situ. La identificación de esta proteína no solo proporciona información pronóstica, sino que también orienta el uso de terapias dirigidas que han demostrado mejorar los resultados clínicos en pacientes seleccionados.
De igual importancia es la evaluación del estado de reparación de desajustes del ADN, comúnmente referido como deficiencia en los sistemas de reparación de desajustes (dMMR), o la presencia de inestabilidad de microsatélites en alto grado (MSI-H). Estos marcadores genómicos ofrecen información sobre la susceptibilidad tumoral a ciertas inmunoterapias y pronostican una respuesta potencialmente favorable a agentes inmunomoduladores.
La determinación de la expresión de proteínas inmunomoduladoras como PD-1 y PD-L1 se ha convertido en un componente clave del estudio molecular del carcinoma gástrico metastásico. Estos factores están implicados en la evasión del sistema inmune por parte del tumor y constituyen objetivos terapéuticos en la era de la inmunoterapia, ampliando las opciones de tratamiento para pacientes con enfermedad avanzada.
Diagnóstico diferencial
La distinción entre los adenocarcinomas gástricos ulcerados y las úlceras gástricas benignas representa un desafío diagnóstico fundamental, dado que ambas entidades pueden presentar características clínicas y endoscópicas similares. Para establecer un diagnóstico certero, la biopsia histológica es indispensable, ya que permite la identificación precisa de células malignas y la diferenciación de procesos benignos. Se ha documentado que aproximadamente un tres por ciento de las úlceras gástricas inicialmente clasificadas como benignas, tras un análisis más profundo, son finalmente confirmadas como malignas, lo que subraya la importancia de un estudio cuidadoso y sistemático.
Por este motivo, todas las lesiones ulceradas detectadas durante la endoscopía deben ser objeto de toma de muestras para biopsia con el fin de descartar la presencia de carcinoma gástrico. Esta práctica clínica se justifica para evitar diagnósticos erróneos que puedan retrasar el tratamiento adecuado y afectar negativamente el pronóstico. En aquellos casos en que la apariencia endoscópica sugiera malignidad o cuando el examen histopatológico revele alteraciones celulares atípicas o displásicas, se recomienda la realización de una endoscopía de control entre dos y tres meses después, con el propósito de evaluar la cicatrización de la lesión y confirmar o descartar el desarrollo de un proceso neoplásico.
Cuando las úlceras persisten sin mostrar signos de curación tras el tratamiento adecuado, deben ser consideradas para resección quirúrgica, dado que la falta de respuesta puede indicar la presencia de un tumor infiltrativo que requiere intervención definitiva.
Asimismo, es necesario distinguir el carcinoma infiltrativo que se manifiesta con engrosamiento de los pliegues gástricos de otras condiciones que pueden simular este hallazgo, como el linfoma gástrico o las gastropatías hipertróficas. Estas últimas se caracterizan por un aumento del grosor de la mucosa gástrica debido a procesos inflamatorios o proliferativos benignos, pero pueden mimetizar la apariencia radiológica o endoscópica de un carcinoma avanzado. Por ello, la evaluación histopatológica y, en ocasiones, la aplicación de técnicas inmunohistoquímicas y moleculares, resultan esenciales para establecer un diagnóstico diferencial preciso y garantizar un tratamiento adecuado y oportuno.
Tratamiento
La resección quirúrgica constituye el pilar terapéutico fundamental en el manejo del adenocarcinoma gástrico en estadios no metastásicos y representa, hasta el momento, la única intervención con potencial curativo. El objetivo primario de la cirugía es la extirpación completa del tumor con márgenes quirúrgicos negativos, lo cual implica la remoción no solo del tejido tumoral, sino también de una porción adecuada de tejido gástrico sano y estructuras linfáticas regionales comprometidas o en riesgo.
La elección de la técnica quirúrgica depende de múltiples factores, incluyendo la localización del tumor, su extensión y la evaluación preoperatoria. En los últimos años, la resección laparoscópica ha ganado protagonismo como alternativa a la gastrectomía abierta tradicional, mostrando resultados comparables en términos oncológicos, pero con menores tasas globales de complicaciones posoperatorias, lo que la convierte en una opción atractiva en centros con experiencia en cirugía mínimamente invasiva.
En determinados casos de cáncer gástrico en etapas muy tempranas, particularmente aquellos confinados a la mucosa (estadios T1aN0) y con un tamaño menor a dos centímetros, es posible realizar una resección endoscópica de la mucosa, una técnica utilizada con éxito en Japón y, cada vez más, en centros altamente especializados de otros países. Esta estrategia, que requiere una estadificación cuidadosa mediante ecografía endoscópica para confirmar la ausencia de invasión submucosa y compromiso ganglionar, ofrece una alternativa terapéutica menos invasiva con potencial curativo en casos seleccionados.
En pacientes con tumores más avanzados, pero sin evidencia radiológica de enfermedad metastásica a distancia, se recomienda realizar una laparoscopia de estadificación antes de proceder con la cirugía definitiva. Esta intervención permite detectar implantes peritoneales u otras metástasis no visualizadas en estudios por imágenes, lo cual evita procedimientos quirúrgicos innecesarios en pacientes con enfermedad incurable. Cabe señalar que aproximadamente una cuarta parte de los pacientes sometidos a cirugía presentan tumores localmente irresecables o metástasis peritoneales, hepáticas o ganglionares distantes, lo que excluye la posibilidad de curación quirúrgica.
En los casos en que la enfermedad se encuentra confinada al estómago, la extensión de la gastrectomía depende del sitio anatómico del tumor. Las lesiones localizadas en los dos tercios distales del estómago son tratadas mediante gastrectomía subtotal, mientras que los tumores proximales o aquellos con patrón de infiltración difusa requieren una gastrectomía total. La resección completa con márgenes negativos es un requisito esencial para el éxito quirúrgico. Dado que la gastrectomía total elimina las células responsables de la producción del factor intrínseco necesario para la absorción de vitamina B12, es imprescindible iniciar una suplementación regular con esta vitamina en el periodo posoperatorio.
Las guías terapéuticas actuales, como las del National Comprehensive Cancer Network, establecen que la cirugía curativa debe incluir una disección ganglionar extensa. Esto puede ser una linfadenectomía D1 (disección de ganglios perigástricos) o una D2 modificada, que implica la resección de ganglios más allá de los inmediatos al tumor. Se recomienda el análisis de al menos quince ganglios linfáticos para una estadificación adecuada. Aunque la linfadenectomía D2 ha demostrado mejorar la supervivencia específica por enfermedad, también se asocia a un mayor riesgo de complicaciones y mortalidad posquirúrgica, especialmente si es realizada en centros con poca experiencia.
A pesar de una resección quirúrgica completa, la supervivencia a cinco años continúa siendo limitada, especialmente en pacientes con afectación ganglionar, donde la recurrencia es común. Por esta razón, el tratamiento quirúrgico debe integrarse dentro de un enfoque multidisciplinario que incluya oncología médica y radioterapia. La administración de quimioterapia perioperatoria, es decir, antes y después de la cirugía, ha demostrado mejorar significativamente los resultados en pacientes con enfermedad localizada o locorregional. Los esquemas de quimioterapia triple, aunque más tóxicos, son preferidos en pacientes con buen estado funcional, ya que ofrecen mejores tasas de respuesta y supervivencia en comparación con los regímenes dobles.
En ciertos contextos, como cuando no se logra una resección completa (R0) o cuando la disección ganglionar ha sido limitada (D1 o menor), la radioterapia posoperatoria puede ofrecer un beneficio adicional. Sin embargo, su utilidad se reduce cuando la linfadenectomía ha sido extensa, debido a que el control locorregional ya ha sido optimizado por la cirugía.
Es importante destacar que los tumores situados en la unión gastroesofágica presentan características biológicas y conductuales particulares, por lo que su abordaje terapéutico se realiza de acuerdo con los protocolos establecidos para el tratamiento del cáncer esofágico, con regímenes quirúrgicos y oncológicos adaptados a esa localización específica.
En el adenocarcinoma gástrico avanzado, las terapias inmunológicas y dirigidas han emergido como estrategias terapéuticas innovadoras que ofrecen nuevas posibilidades, especialmente en pacientes con enfermedad localmente avanzada o metastásica que no son candidatos a cirugía curativa. Estas terapias se fundamentan en la identificación de alteraciones moleculares específicas que permiten personalizar el tratamiento según el perfil biológico del tumor, mejorando así la eficacia y reduciendo potencialmente la toxicidad sistémica.
La inmunoterapia, en particular, se ha convertido en una herramienta prometedora en el tratamiento del cáncer gástrico avanzado. Su efectividad depende de la presencia de ciertos biomarcadores tumorales que predicen la probabilidad de respuesta. Por ello, en pacientes con enfermedad avanzada, se recomienda realizar estudios específicos para detectar inestabilidad de microsatélites (MSI-H), deficiencia en los sistemas de reparación de errores de apareamiento del ADN (dMMR), y la expresión de proteínas inmunorreguladoras como PD-1 y su ligando PD-L1. Estas alteraciones indican que el tumor presenta una elevada carga mutacional o un microambiente inmunológicamente activo, lo cual lo hace susceptible a la acción de fármacos inhibidores de puntos de control inmunitario, como los anticuerpos anti-PD-1.
Entre los adenocarcinomas gástricos, la inestabilidad de microsatélites o deficiencia en la reparación de desajustes se detecta en aproximadamente entre el ocho y el dieciséis por ciento de los casos. Por otro lado, la amplificación del gen HER2, que codifica un receptor de membrana asociado al crecimiento celular, está presente en cerca del veintidós por ciento de los pacientes. En estos últimos, el uso de terapias dirigidas contra HER2, como los anticuerpos monoclonales trastuzumab y trastuzumab deruxtecán, ha demostrado beneficios significativos en términos de control tumoral y supervivencia. Así, el análisis molecular del tumor es esencial para seleccionar adecuadamente a los candidatos que pueden beneficiarse de estas terapias.
En términos generales, los esquemas de tratamiento sistémico utilizados en el adenocarcinoma gástrico avanzado son similares a los empleados en el adenocarcinoma de esófago y de la unión gastroesofágica, dada la similitud biológica y de comportamiento clínico entre estos tumores.
Sin embargo, a pesar de los avances en terapias sistémicas, una proporción importante de pacientes es diagnosticada en fases avanzadas con enfermedad no resecable, ya sea por metástasis a distancia, carcinomatosis peritoneal o invasión local de estructuras adyacentes. En estos casos, el tratamiento no se orienta a la curación, sino al alivio de los síntomas y a la mejora de la calidad de vida mediante estrategias paliativas adaptadas a las necesidades y al estado funcional del paciente.
En determinadas circunstancias, una resección paliativa del tumor puede estar indicada, especialmente si este provoca sangrado persistente, dolor refractario u obstrucción del tracto de salida gástrico. En pacientes con buena reserva funcional que presentan obstrucción gástrica, pero sin posibilidad de resección curativa, puede realizarse una derivación quirúrgica mediante una gastro-yeyunostomía, que permite restablecer el tránsito alimentario y evitar complicaciones obstructivas.
En pacientes con metástasis diseminadas y un estado funcional aún conservado, puede considerarse el inicio de tratamiento sistémico paliativo con quimioterapia o terapias dirigidas, con el objetivo de prolongar la supervivencia y controlar los síntomas. Sin embargo, en aquellos pacientes con expectativas de vida limitadas o con un estado clínico deteriorado, el enfoque paliativo debe centrarse en intervenciones menos invasivas. Entre estas se incluyen la colocación endoscópica de prótesis para aliviar obstrucciones, la radioterapia localizada para controlar hemorragias o el dolor, y la embolización angiográfica en casos de sangrado persistente cuando otras medidas no son factibles.
En resumen, el tratamiento del cáncer gástrico en fases avanzadas requiere un enfoque personalizado, basado tanto en las características moleculares del tumor como en el estado clínico del paciente. La integración de inmunoterapias, terapias dirigidas y modalidades paliativas permite ofrecer opciones terapéuticas adaptadas que, aunque no siempre curativas, pueden proporcionar alivio sintomático significativo, prolongar la supervivencia y mejorar sustancialmente la calidad de vida.
Pronóstico
La supervivencia a cinco años en el cáncer gástrico es altamente variable y depende de múltiples factores interrelacionados, entre los que destacan el estadio clínico al momento del diagnóstico, la localización anatómica del tumor y sus características histopatológicas. Estas variables no solo determinan la posibilidad de realizar un tratamiento curativo, sino también influyen en la respuesta terapéutica y en el comportamiento biológico de la neoplasia.
El estadio de la enfermedad es, sin duda, el principal determinante pronóstico. En aquellos pacientes que son diagnosticados en etapas tempranas —particularmente en los estadios IA y IB— y que son tratados mediante resección quirúrgica con intención curativa, las tasas de supervivencia a cinco años pueden alcanzar cifras alentadoras, que oscilan entre el sesenta y el ochenta por ciento. Este desenlace favorable se atribuye a que los tumores en estas fases iniciales suelen estar confinados a la mucosa o submucosa gástrica, sin invasión profunda ni diseminación a ganglios linfáticos o a distancia.
En contraste, los tumores diagnosticados en fases más avanzadas presentan un pronóstico significativamente más desfavorable. Por ejemplo, en el estadio IIIC —caracterizado por la invasión profunda de la pared gástrica y la presencia de múltiples ganglios linfáticos comprometidos— la tasa de supervivencia a cinco años se reduce drásticamente a niveles tan bajos como el dieciocho por ciento. Esta disminución refleja tanto la alta carga tumoral como la probabilidad elevada de diseminación microscópica no detectable en estudios de imagen, lo que favorece la recurrencia incluso tras cirugía radical y tratamiento adyuvante.
Otro elemento pronóstico de gran importancia es la localización tumoral. Los adenocarcinomas que se originan en la porción proximal del estómago —es decir, en el cardias o la unión gastroesofágica— tienden a mostrar un comportamiento más agresivo que los que afectan el antro o el cuerpo gástrico distal. Incluso en pacientes con enfermedad aparentemente localizada, la supervivencia a cinco años de los tumores proximales rara vez supera el quince por ciento. Esta localización anatómica se asocia con una mayor dificultad técnica para lograr márgenes quirúrgicos negativos, una tasa más elevada de afectación ganglionar y una tendencia a invadir estructuras adyacentes como el esófago inferior, lo que complica tanto el abordaje quirúrgico como el tratamiento sistémico.
Además de estos factores clínico-patológicos, el subtipo histológico también influye en el pronóstico. El adenocarcinoma de tipo intestinal, por ejemplo, suele tener un curso más lento y una respuesta terapéutica más favorable, mientras que el tipo difuso, caracterizado por células en anillo de sello y crecimiento infiltrativo, se asocia con peor pronóstico debido a su tendencia a la diseminación precoz y la escasa delimitación tumoral.
Para los pacientes cuya enfermedad progresa a pesar de la terapia quirúrgica o sistémica, y en quienes se pierde la posibilidad de control oncológico definitivo, los cuidados paliativos se convierten en una prioridad esencial. El enfoque paliativo no solo busca el alivio sintomático —como el control del dolor, la obstrucción o el sangrado—, sino que también se orienta a mantener la calidad de vida y acompañar al paciente en la toma de decisiones médicas complejas en etapas terminales. Esta atención debe ser integral y multidisciplinaria, incluyendo el soporte emocional, nutricional y espiritual, según las necesidades individuales del paciente y su entorno familiar.

Fuente y lecturas recomendadas:
- ASGE Standards of Practice Committee; Jue TL et al. ASGE guideline on the role of endoscopy in the management of benign and malignant gastroduodenal obstruction. Gastrointest Endosc. 2021;93:309. [PMID: 33168194]
- de Steur WO et al; CRITICS investigators. Adjuvant chemotherapy is superior to chemoradiation after D2 surgery for gastric cancer in the per-protocol analysis of the randomized CRITICS trial. Ann Oncol. 2021;32:360. [PMID: 33227408]
- Huang RJ et al. An approach to the primary and secondary prevention of gastric cancer in the United States. Clin Gastroenterol Hepatol. 2022;20:2218. [PMID: 34624563]
- Joshi SS et al. Current treatment and recent progress in gastric cancer. CA Cancer J Clin. 2021;71:264. [PMID: 33592120]
- Kawazoe A et al. Current status of immunotherapy for advanced gastric cancer. Jpn J Clin Oncol. 2021;51:20. [PMID: 33241322]
- Li D et al. Effect of Helicobacter pylori eradication therapy on the incidence of noncardia gastric adenocarcinoma in a large diverse population in the United States. Gastroenterology. 2023;165:391. [PMID: 37142201]
- Ng SP et al. Role of radiation therapy in gastric cancer. Ann Surg Oncol. 2021;28:4151. [PMID: 33689079]
- Shah SC et al. Population-based analysis of differences in gastric cancer incidence among races and ethnicities in individuals age 50 years and older. Gastroenterology. 2020;159:1705. [PMID: 32771406]
- Zhu Y et al. HER2-targeted therapies in gastric cancer. Biochim Biophys Acta Rev Cancer. 2021;1876:188549. [PMID: 33894300]