La miastenia gravis es un trastorno autoinmune crónico caracterizado por una debilidad fluctuante de los músculos voluntarios, que empeora con la actividad y mejora con el descanso. Esta enfermedad puede manifestarse a cualquier edad, aunque muestra predilección por ciertos grupos etarios y sexuales según su asociación con otras condiciones inmunológicas o neoplásicas. Su aparición es más frecuente en mujeres jóvenes que presentan el alelo HLA-DR3, lo que sugiere una predisposición genética relacionada con el complejo mayor de histocompatibilidad. No obstante, cuando la miastenia gravis se asocia a timomas —tumores del timo—, es más común en varones de edad avanzada.
El inicio de los síntomas suele ser insidioso y progresivo, lo cual puede dificultar su diagnóstico temprano. Sin embargo, en algunos casos, la enfermedad puede evidenciarse de forma abrupta ante la presencia de factores estresantes, como infecciones intercurrentes, que exacerban el cuadro clínico y revelan la disfunción neuromuscular subyacente. También se han descrito exacerbaciones en momentos específicos del ciclo hormonal, como en la fase premenstrual, durante el embarazo o poco después del parto, lo cual apunta a una posible influencia inmunoendocrina en la actividad de la enfermedad.
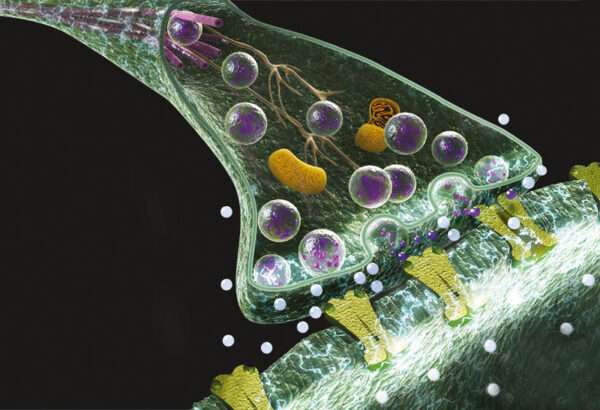
Desde el punto de vista fisiopatológico, los síntomas de la miastenia gravis se explican por un bloqueo variable de la transmisión neuromuscular. Este bloqueo es causado fundamentalmente por la presencia de autoanticuerpos dirigidos contra los receptores de acetilcolina ubicados en la membrana postsináptica de la unión neuromuscular. Estos autoanticuerpos están presentes en la mayoría de los pacientes y tienen un papel primario en la reducción del número de receptores funcionales, ya sea por destrucción directa, por internalización acelerada del receptor, o por interferencia con la unión de la acetilcolina. El resultado de esta agresión inmunológica es una disminución en la eficacia de la transmisión del impulso nervioso hacia el músculo, lo que genera la característica debilidad muscular que define a la enfermedad.
Además de los mecanismos humorales, se ha evidenciado también una participación de la inmunidad celular en la patogenia de la miastenia gravis. Células T autorreactivas específicas para el receptor de acetilcolina contribuyen a la perpetuación de la respuesta autoinmune, lo que indica que el trastorno no se limita a la producción de anticuerpos, sino que involucra una desregulación más compleja del sistema inmunológico.
Manifestaciones clínicas
La miastenia gravis se manifiesta clínicamente mediante una serie de signos y síntomas que reflejan la debilidad y la fatigabilidad de los músculos esqueléticos, debido a la disfunción en la transmisión neuromuscular. Los pacientes pueden presentar una variedad de síntomas que incluyen ptosis (caída del párpado superior), diplopia (visión doble), dificultades para masticar o tragar, problemas respiratorios, debilidad en los miembros, o una combinación de estos. En muchos casos, la debilidad muscular permanece localizada en grupos musculares específicos, como los músculos oculares o los músculos de la masticación y la deglución, pero en otros casos puede volverse generalizada, afectando a una mayor cantidad de músculos.
La afectación de los músculos extraoculares (que controlan el movimiento de los ojos) es particularmente común en la miastenia gravis, y esto suele dar lugar a parálisis ocular y ptosis, que frecuentemente son asimétricas, es decir, no se presentan de manera uniforme en ambos lados del cuerpo. A pesar de la disfunción muscular, las respuestas pupilares suelen permanecer normales, lo que ayuda a diferenciar la miastenia gravis de otros trastornos neurológicos que también afectan la función ocular. Además, los músculos bulbares (aquellos que están involucrados en la masticación, deglución y habla) y los músculos de los miembros pueden estar debilitados, pero el patrón de la debilidad es variable entre los pacientes.
Una característica distintiva de la miastenia gravis es la fluctuación diurna de los síntomas. La debilidad muscular tiende a empeorar a lo largo del día, especialmente después de períodos de actividad sostenida, y mejora con el descanso breve. Esta variabilidad diaria en la intensidad de los síntomas se superpone a la tendencia a sufrir episodios más largos de recaídas y remisiones espontáneas, que pueden durar semanas. Esta fluctuación de los síntomas refleja la naturaleza dinámica de la enfermedad, en la que los cambios en la respuesta inmunitaria y en la función neuromuscular pueden generar periodos de estabilidad y empeoramiento.
En cuanto al curso de la enfermedad, la miastenia gravis sigue una progresión lenta, aunque en algunos casos puede tener un desenlace fatal debido a complicaciones respiratorias, como la neumonía por aspiración. Esta complicación se produce cuando los músculos responsables de la respiración se debilitan, lo que puede interferir con la capacidad del paciente para mantener una respiración adecuada, especialmente durante episodios agudos de debilidad muscular.
Exámenes diagnósticos
El diagnóstico de miastenia gravis se confirma mediante un examen clínico que demuestra la debilidad y la fatigabilidad de los músculos afectados. En la mayoría de los casos, los músculos extraoculares están involucrados, lo que lleva a la aparición de parálisis ocular y ptosis. Además, los músculos bulbares y los de los miembros pueden estar débiles, pero el patrón de debilidad varía de un paciente a otro. Un hallazgo característico es que la debilidad muscular se incrementa con la actividad sostenida y mejora con el descanso, lo que ayuda a diferenciarla de otras condiciones neuromusculares. Los reflejos y la sensación suelen permanecer normales, lo que también es un signo distintivo de la enfermedad.
En situaciones de crisis miasténica, que son exacerbaciones graves de la enfermedad, la debilidad respiratoria puede ser tan severa que requiere intervención inmediata, y los pacientes deben ser ingresados en unidades de cuidados intensivos (UCI). En estas circunstancias, la monitorización de la función respiratoria y el soporte ventilatorio son fundamentales para estabilizar al paciente y prevenir complicaciones fatales.
El diagnóstico de miastenia gravis se basa en una combinación de pruebas serológicas, electrofisiológicas y de imagen. Una de las pruebas más útiles es la determinación de anticuerpos contra el receptor de acetilcolina en suero, ya que presenta una sensibilidad de entre el 80 y el 90% para el diagnóstico de la enfermedad. Esta prueba permite detectar la presencia de los anticuerpos que bloquean la transmisión neuromuscular. Sin embargo, hay pacientes que no presentan estos anticuerpos, pero tienen anticuerpos contra la tirosina quinasa específica de músculo (MuSK). En estos casos, la prueba de MuSK es esencial, ya que estos pacientes tienden a presentar debilidad en los músculos faciales, respiratorios y proximales con mayor frecuencia que aquellos con anticuerpos contra el receptor de acetilcolina. De forma excepcional, algunos pacientes con miastenia gravis pueden tener anticuerpos contra la proteína relacionada con el receptor LDL 4(LRP4), lo que también debe ser evaluado para un diagnóstico completo.
La evaluación electrofisiológica es otra herramienta crucial en el diagnóstico. La respuesta decrementada a la estimulación repetitiva de 2 o 3 Hz en los nervios motores es indicativa de un trastorno en la transmisión neuromuscular. Esta anomalía puede ser detectada incluso en músculos que clínicamente parecen normales, utilizando procedimientos provocativos específicos. La electromiografía con aguja en los músculos afectados muestra una variabilidad significativa en la configuración y el tamaño de los potenciales de las unidades motoras individuales. Además, la electromiografía de fibra única revela un aumento del «jitter», es decir, una variabilidad en el intervalo de tiempo entre dos potenciales de acción de fibras musculares pertenecientes a la misma unidad motora, lo que es indicativo de la alteración en la transmisión neuromuscular.
En pacientes en los que se sospecha la presencia de un timoma, es fundamental realizar una tomografía computarizada (TC) de tórax, con y sin contraste, para identificar la posible coexistencia de este tumor tímico, que se encuentra en un porcentaje significativo de pacientes con miastenia gravis. La identificación de un timoma tiene implicaciones importantes en el manejo y pronóstico de la enfermedad.
Tratamiento
El tratamiento de la miastenia gravis se basa en varias estrategias terapéuticas que buscan aliviar los síntomas, mejorar la calidad de vida del paciente y, en algunos casos, modificar la evolución de la enfermedad. Sin embargo, es importante destacar que las terapias disponibles no modifican el curso subyacente de la enfermedad, sino que se centran en reducir la intensidad de los síntomas y prevenir complicaciones graves.
Una de las opciones más utilizadas son los medicamentos anticolinesterásicos, como la neostigmina y la piridostigmina, que proporcionan un alivio sintomático al aumentar la cantidad de acetilcolina disponible en la unión neuromuscular, contrarrestando así la disfunción en la transmisión neuromuscular. Estos medicamentos no alteran el proceso patológico subyacente, pero mejoran la fuerza muscular al inhibir la enzima colinesterasa, responsable de la degradación de la acetilcolina. La dosis se ajusta de forma individualizada, dependiendo de la respuesta clínica de cada paciente, con una dosis habitual de neostigmina de 7,5 a 30 mg, administrada por vía oral cuatro veces al día, siendo la dosis promedio de 15 mg. Por su parte, la piridostigmina se administra en un rango de 30 a 180 mg, con una dosis promedio de 60 mg también cuatro veces al día. Es fundamental tener cuidado con la sobredosis de estos fármacos, ya que un exceso puede empeorar temporalmente la debilidad muscular.
Además de los anticolinesterásicos, es crucial evitar ciertos medicamentos que pueden exacerbar la miastenia gravis, como los aminoglucósidos, que son antibióticos capaces de interferir con la transmisión neuromuscular y empeorar la debilidad en estos pacientes.
Para aquellos pacientes que no responden adecuadamente a los anticolinesterásicos, el tratamiento con corticosteroidespuede ser indicado. Los corticosteroides son útiles en pacientes con miastenia gravis moderada a grave, especialmente cuando la debilidad no se controla adecuadamente con la medicación anticolinesterásica. El uso de corticosteroides, como la prednisona, se inicia generalmente de forma gradual, comenzando con dosis bajas para evitar efectos adversos severos, como una exacerbación temporal de la debilidad muscular y, en algunos casos, insuficiencia respiratoria, que puede ocurrir durante las primeras 1 a 2 semanas si se administra una dosis alta inicial. En los pacientes estables, los corticosteroides deben iniciarse de manera gradual en el ámbito ambulatorio. Una dosis inicial comúnmente utilizada es de 20 mg de prednisona oralmente al día, aumentando gradualmente en incrementos de 10 mg semanalmente hasta alcanzar un objetivo de 1 mg por kilogramo de peso corporal al día, con un máximo de 100 mg diarios. Esta dosis de mantenimiento puede ser ajustada dependiendo de la respuesta clínica del paciente.
En pacientes hospitalizados con formas severas de miastenia gravis, se pueden administrar tratamientos de inmunoglobulina intravenosa (IVIG) o plasmapheresis, terapias que tienen un inicio de acción rápido y que pueden ayudar a contrarrestar la debilidad inicial que suele producirse al comenzar el tratamiento con corticosteroides. Estos tratamientos rápidos permiten que el paciente tolere mejor la introducción de corticosteroides a dosis más altas al principio. A medida que la situación clínica del paciente mejora, los corticosteroides pueden ser disminuidos progresivamente hasta un nivel de mantenimiento relativamente bajo, por ejemplo, 10 mg diarios de prednisona. Sin embargo, la suspensión total de los corticosteroides es extremadamente difícil, ya que puede desencadenar una recaída de los síntomas.
Los corticosteroides pueden administrarse como tratamiento alternado, en el que se administran dosis altas en días alternos, lo que puede ayudar a reducir los efectos secundarios comunes, como el aumento de peso, la osteoporosis y la hipertensión. Este régimen alternado, en comparación con el tratamiento diario, puede ser más tolerable a largo plazo.
El tratamiento de la miastenia gravis, particularmente en formas moderadas a graves, puede implicar el uso de inmunosupresores adicionales con el objetivo de reducir la necesidad de corticosteroides, que, aunque efectivos, pueden producir efectos secundarios indeseables cuando se administran a largo plazo. Azatioprina, uno de los inmunosupresores más utilizados, ha demostrado ser eficaz al permitir la reducción de la dosis de corticosteroides sin comprometer el control de los síntomas. La azatioprina actúa inhibiendo la síntesis de ADN, lo que reduce la proliferación de linfocitos T y B responsables de la respuesta autoinmune en la miastenia gravis. La dosis habitual de azatioprina es de 2 a 3 mg por kilogramo de peso corporal, administrada por vía oral de forma diaria, comenzando con una dosis inicial más baja para evitar posibles efectos adversos.
Otros agentes inmunosupresores también se utilizan con el mismo propósito de reducir la dosis de corticosteroides. Entre estos se incluyen el micofenolato mofetil, el rituximab, la ciclosporina, el metotrexato y el tacrolimus. Estos fármacos tienen mecanismos de acción distintos, pero todos ellos contribuyen a reducir la actividad del sistema inmune, lo que puede ayudar a controlar la miastenia gravis de manera más eficiente y, a su vez, disminuir la necesidad de altas dosis de corticosteroides. El micofenolato mofetil, por ejemplo, inhibe la proliferación de linfocitos T y B, mientras que el rituximab actúa contra los linfocitos B, bloqueando su función en la producción de anticuerpos patógenos.
En los últimos años, también han emergido terapias biológicas más específicas dirigidas a modular de manera precisa la respuesta inmune en la miastenia gravis. El efgartigimod y el rozanolixizumab son anticuerpos monoclonales que actúan sobre el receptor neonatal Fc, lo que disminuye los niveles de inmunoglobulina G circulante, los cuales son responsables de la autoinmunidad en miastenia gravis. Ambos tratamientos han demostrado mejorar la función motora en semanas tras su administración y están aprobados para pacientes con miastenia gravis positiva para anticuerpos contra el receptor de acetilcolina. El efgartigimod se administra por vía intravenosa o subcutánea, con un ciclo inicial de tratamiento semanal durante cuatro semanas, seguido de ciclos de tratamiento cada cuatro semanas según la respuesta clínica, con un intervalo de al menos 50 días entre los ciclos. El rozanolixizumab se administra subcutáneamente una vez a la semana durante seis semanas, con ciclos posteriores basados en la respuesta clínica, separados por al menos 63 días. El rozanolixizumab también está aprobado para pacientes con miastenia gravis positiva para anticuerpos contra la tirosina quinasa específica de músculo (MuSK).
El tratamiento con inhibidores del complemento también ha ganado aceptación en el tratamiento de la miastenia gravis, especialmente en aquellos pacientes con anticuerpos contra el receptor de acetilcolina. Tres inhibidores del complemento han sido aprobados para su uso en estos pacientes: zilucoplan, ravulizumab y eculizumab. El zilucoplan se administra una vez al día por inyección subcutánea, ajustado según el peso corporal real del paciente. Ravulizumab se administra por vía intravenosa, comenzando con una dosis de carga basada en el peso corporal, seguida de una dosis de mantenimiento cada ocho semanas a partir de dos semanas después de la dosis de carga. El eculizumab se reserva para pacientes con enfermedad refractaria que no han respondido adecuadamente a al menos dos terapias inmunosupresoras alternativas. Este se administra por vía intravenosa durante cinco semanas inicialmente y luego cada dos semanas. Es crucial que los pacientes que reciben estos tratamientos sean vacunados contra meningococo antes de comenzar la terapia, ya que el bloqueo del complemento puede aumentar la susceptibilidad a infecciones bacterianas graves como la meningitis meningocócica.
En pacientes con discapacidad grave debido a la miastenia gravis, el tratamiento con plasmapheresis o inmunoglobulina intravenosa (IVIG) puede ser particularmente beneficioso, ya que ambas terapias han demostrado tener una eficacia similar en la mejora rápida de los síntomas. Estas terapias no modifican el curso de la enfermedad, pero pueden proporcionar un alivio sintomático significativo en situaciones agudas, al reducir la cantidad de anticuerpos patógenos circulantes que interfieren con la transmisión neuromuscular. La plasmapheresis es un procedimiento que implica la extracción del plasma sanguíneo del paciente, seguido de su filtrado para eliminar los anticuerpos dañinos, y luego se devuelve el plasma tratado al paciente. Por otro lado, la inmunoglobulina intravenosa actúa al suministrar anticuerpos sanos que modularán la respuesta inmune y neutralizarán los autoanticuerpos responsables del daño a los receptores de acetilcolina. Ambas terapias son particularmente útiles en crisis miasténicas, cuando la debilidad respiratoria y la dificultad para mantener funciones vitales se vuelven una amenaza para la vida del paciente. Además, estas terapias también juegan un papel importante en la estabilización de pacientes antes de someterlos a una timectomía, un procedimiento quirúrgico que puede mejorar el pronóstico a largo plazo.
La timectomía, o extirpación quirúrgica del timo, es un tratamiento clave en aquellos pacientes que presentan timoma(un tumor del timo), ya que la presencia de este tumor puede estar vinculada a la disfunción inmunológica en la miastenia gravis. Sin embargo, estudios recientes han demostrado que la timectomía puede ser beneficiosa incluso en pacientes sin timoma visible. Un importante ensayo clínico multicéntrico aleatorizado reveló que los pacientes que se sometieron a timectomía, incluso en ausencia de un timoma radiológicamente identificable, mostraron una mejora en la fuerza muscular, una reducción en los requerimientos de inmunosupresores y una menor cantidad de hospitalizaciones en comparación con aquellos que no recibieron la cirugía. Estos resultados sugieren que la timectomía puede tener efectos inmunomoduladores y favorecer la remisión espontánea o la mejoría clínica en la miastenia gravis, posiblemente a través de la alteración de la función del timo en la regulación de la respuesta inmune.
En general, se recomienda que la timectomía se considere en todos los pacientes menores de 65 años, a menos que la debilidad esté estrictamente limitada a los músculos extraoculares, que son menos afectados por la miastenia gravis. Si la enfermedad tiene un inicio reciente y una progresión lenta, la intervención quirúrgica puede demorarse durante un período de tiempo, generalmente un año, con la esperanza de que se produzca una remisión espontáneao que la enfermedad se estabilice sin necesidad de cirugía. Sin embargo, en los casos de miastenia gravis grave o en aquellos en los que la respuesta a tratamientos farmacológicos es insuficiente, la timectomía ofrece un enfoque terapéutico que puede mejorar considerablemente el control de la enfermedad a largo plazo.

Fuente y lecturas recomendadas:
- Goldman, L., & Schafer, A. I. (Eds.). (2020). Goldman-Cecil Medicine (26th ed.). Elsevier.
- Loscalzo, J., Fauci, A. S., Kasper, D. L., Hauser, S. L., Longo, D. L., & Jameson, J. L. (Eds.). (2022). Harrison. Principios de medicina interna (21.ª ed.). McGraw-Hill Education.
- Papadakis, M. A., McPhee, S. J., Rabow, M. W., & McQuaid, K. R. (Eds.). (2024). Diagnóstico clínico y tratamiento 2025. McGraw Hill.
- Rozman, C., & Cardellach López, F. (Eds.). (2024). Medicina interna (20.ª ed.). Elsevier España.
Originally posted on 13 de abril de 2025 @ 1:15 PM