Patología de la hiperplasia benigna de próstata

La hiperplasia benigna de próstata (HBP), también conocida como hiperplasia nodular, constituye la patología prostática benigna más prevalente en varones mayores de 50 años. Aproximadamente el 30% de los individuos en este grupo etario presenta síntomas de HBP de moderados a intensos. La evidencia histológica de esta condición es detectada en hasta un 90% de los hombres a la edad de 80 años.
Este fenómeno, caracterizado por un aumento excesivo en el tamaño de la glándula prostática, específicamente alrededor de la uretra masculina, se manifiesta clínicamente a través de diversos síntomas urinarios. La dificultad para orinar, la micción frecuente, la urgencia para orinar y la sensación de incapacidad para vaciar completamente la vejiga son manifestaciones comunes de la híperplasia benigna de próstata.
Es imperativo destacar que la HBP no se clasifica como una lesión premaligna, y carece de asociación con el desarrollo de cáncer de próstata. La prevalencia de esta entidad benigna aumenta con la edad, siendo notable la presencia histológica en un porcentaje significativo de hombres octogenarios.
El crecimiento exagerado de la próstata en la hiperplasia benigna de próstata ejerce presión sobre la uretra, afectando el flujo urinario normal. Aunque la HBP y el cáncer de próstata comparten la misma localización anatómica, son entidades distintas desde el punto de vista patológico y evolutivo.
El diagnóstico de la HBP implica una evaluación integral que incluye la consideración de los síntomas presentes, exámenes físicos específicos y pruebas diagnósticas como análisis sanguíneos y estudios urodinámicos. En cuanto al tratamiento, se establece un abanico que va desde modificaciones en el estilo de vida hasta el uso de medicamentos, reservando intervenciones quirúrgicas para casos más severos.
Etiología y patogénia de la hipertrofia prostática benigna
Papel de la dihidrotestosterona
La dihidrotestosterona (DHT) desempeña un papel crucial en la regulación de la próstata y está estrechamente vinculada a la acción de las enzimas 5α-reductasas, específicamente la 5a-reductasa de tipo 2. La síntesis de DHT tiene lugar en la próstata, donde se origina a partir de la testosterona mediante la acción de esta enzima.
La 5a-reductasa de tipo 2, responsable de la conversión de testosterona en DHT, se expresa principalmente en las células del estroma prostático. Es importante señalar que esta enzima no se manifiesta en las células epiteliales de la próstata. Este mecanismo intraprostático es fundamental para la generación local de DHT, que actúa de manera específica en la próstata.
Por otro lado, la 5α-reductasa de tipo 1 es otra enzima relevante en el proceso de síntesis de DHT, pero su acción se produce en ubicaciones extraprostáticas, como el hígado y la piel. Este tipo de 5α-reductasa contribuye a proporcionar una fuente adicional de DHT que alcanza la próstata a través de la circulación sanguínea.
La DHT, una vez generada, ejerce su función al unirse y activar los receptores de andrógenos presentes en las células de la próstata, tanto en el estroma como en el epitelio. La DHT es más potente que la testosterona, ya que tiene una mayor afinidad por los receptores de andrógenos y forma complejos más estables con ellos.
Cuando la DHT se une a los receptores de andrógenos, se desencadena una serie de eventos intracelulares. La unión estimula a los receptores de andrógenos a trasladarse desde el citoplasma al núcleo celular, donde activan la transcripción de genes dependientes de andrógenos. Estos genes codifican diversos factores de crecimiento y sus receptores, desempeñando un papel crucial en la regulación del crecimiento y la función celular prostática.
Factores regulados
Los factores de crecimiento, elementos cruciales en la regulación del desarrollo prostático, incluyen a los miembros destacados de la familia del factor de crecimiento de los fibroblastos (FGF) y del factor de crecimiento transformante (TGF)-β, cuya expresión se encuentra regulada al alza en este contexto biológico.
Los FGF, generados por las células del estroma prostático, desempeñan un papel fundamental como reguladores paracrinos durante el desarrollo prostático embrionario. Su función se centra en estimular el crecimiento epitelial bajo la influencia de andrógenos. No obstante, se ha observado que algunas de estas vías regulatorias, inicialmente activas durante el desarrollo embrionario, pueden ser “reactivadas” en la edad adulta, contribuyendo al crecimiento prostático asociado con la hiperplasia benigna de próstata (HBP). Los FGF emergen como actores clave en la señalización paracrina, modulando la interacción entre células epiteliales y del estroma en la próstata.
En el caso del TGF-β, este factor de crecimiento actúa como mitógeno para fibroblastos y otras células mesenquimatosas, promoviendo su proliferación. Sin embargo, se destaca su efecto inhibitorio sobre la proliferación de células epiteliales prostáticas. Aunque la causa última de la HBP permanece en parte desconocida, se postula que los factores de crecimiento inducidos por la dihidrotestosterona (DHT) desempeñan un papel relevante en este contexto. Se sugiere que estos factores, impulsados por la DHT, podrían aumentar la proliferación de células del estroma y simultáneamente reducir la muerte de las células epiteliales, contribuyendo así al crecimiento prostático característico de la HBP.
Papel de los estrógenos
Los andrógenos, si bien se reconocen por desempeñar un papel permisivo en la patogenia de la hiperplasia benigna de próstata, la evidencia actual sugiere que los estrógenos también juegan un papel significativo en este contexto. Dos formas distintas de receptor de estrógeno (RE), REα y REβ, exhiben efectos opuestos en la proliferación celular prostática: REα tiene efectos proliferativos, mientras que REβ muestra propiedades antiproliferativas.
El equilibrio entre estos receptores de estrógeno parece ser crucial en la homeostasis prostática, y su alteración puede contribuir al desarrollo de la hiperplasia benigna de próstata. Los estrógenos afectan la próstata a través de diversos mecanismos, incluyendo la inducción de apoptosis, la modulación de la expresión de aromatasa y la regulación paracrina mediante la prostaglandina E₁.
La apoptosis, o muerte celular programada, es uno de los mecanismos por los cuales los estrógenos influyen en la próstata. La acción de los estrógenos puede modular la tasa de apoptosis, afectando así el equilibrio entre la proliferación y la muerte celular en la próstata.
La expresión de aromatasa, una enzima que convierte los andrógenos en estrógenos, también está implicada en la acción de estos últimos en la próstata. La presencia de estrógenos locales, derivados de la conversión local de andrógenos, puede tener efectos significativos en la proliferación celular prostática.
Además, la prostaglandina E₁, un mediador celular, se destaca como un elemento en la regulación paracrina mediada por estrógenos en la próstata. La acción de los estrógenos a través de esta vía puede influir en la comunicación entre las células de la próstata, contribuyendo a la patogénesis de la hiperplasia benigna de próstata.
Histopatología de la hiperplasia benigna de próstata
En la hiperplasia benigna de próstata, se observan cambios marcados en la morfología y estructura prostática. Este trastorno se caracteriza por un significativo aumento de peso de la próstata, que puede alcanzar de 3 a 5 veces su tamaño normal, situándose en un rango de 60 a 100 gramos, con la posibilidad de un agrandamiento aún mayor.
La HBP afecta específicamente la zona de transición de la próstata, llevando a una invasión de la uretra y la consiguiente compresión que resulta en la formación de un orificio uretral con forma de hendidura.
En el análisis microscópico de la próstata afectada por HBP, se evidencian nódulos hiperplásicos en el corte transversal, mostrando variaciones en color y consistencia, características determinadas por su contenido celular.
La diferenciación entre nódulos glándulares y estromales revela peculiaridades distintivas. Los nódulos predominantemente glandulares exhiben un tono amarillo rosado, una textura blanda y la capacidad de secretar un líquido prostático blanco lechoso. En contraste, aquellos compuestos principalmente por estroma fibromuscular presentan un color gris pálido y una consistencia más dura.
A nivel microscópico, cada nódulo individual contiene glándulas que varían en tamaño, desde pequeñas hasta grandes o quísticamente dilatadas. Estas glándulas están separadas por células del estroma fusiformes y aparentemente inofensivas.
Las glándulas, en su estructura más íntima, están revestidas por dos capas celulares distintas. Una capa interna compuesta por células secretoras cilíndricas y una capa externa de epitelio basal cúbico o aplanado. La conformación de las glándulas puede generar una arquitectura papilar.
En situaciones donde las glándulas han experimentado un notable aumento en tamaño, la afectación del suministro vascular puede resultar en infartos prostáticos. Estos infartos, a su vez, pueden asociarse con áreas adyacentes de metaplasia escamosa, indicando alteraciones morfológicas adicionales.
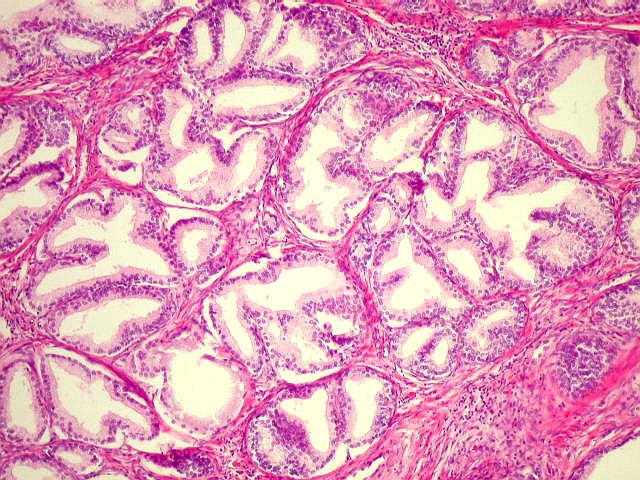
Histopatología de la hiperplasia benigna de próstata
Manifestaciones clínicas
La hiperplasia benigna de próstata (HBP) se manifiesta a través de síntomas primordialmente asociados a la obstrucción urinaria ocasionada por el aumento en tamaño de la próstata y la contracción del estroma mediada por el músculo liso prostático.
Este incremento en la resistencia al flujo urinario conlleva a la hipertrofia y distensión de la vejiga, generando retención de orina. La incapacidad para vaciar completamente la vejiga resulta en un depósito residual de orina, constituyendo una fuente común de infección.
Los pacientes afectados experimentan un aumento en la frecuencia urinaria, nicturia (necesidad de orinar durante la noche), dificultad para iniciar y detener el chorro de orina, goteo por rebosamiento y disuria (micción dolorosa). Estos síntomas, junto con la retención de orina, aumentan el riesgo de infecciones bacterianas en la vejiga y los riñones.
En situaciones más críticas, algunos individuos sufren episodios de retención urinaria aguda, una condición repentina que demanda un sondaje urgente para aliviar la obstrucción y permitir el vaciado de la vejiga.
Tratamiento de la hiperplasia benigna de próstata
La abordaje de la hiperplasia benigna de próstata (HBP) sintomática implica estrategias médicas y, en situaciones más complejas y refractarias a tratamientos conservadores, se recurre a intervenciones invasivas. A continuación, se desglosan los conceptos pertinentes:
- Tratamiento Médico: La HBP sintomática se gestiona farmacológicamente con bloqueantes α-adrenérgicos e inhibidores de la 5α-reductasa. Los bloqueantes α-adrenérgicos actúan reduciendo el tono del músculo liso prostático mediante la inhibición de los receptores α1-adrenérgicos. Por su parte, los inhibidores de la 5α-reductasa reducen la próstata físicamente al disminuir la síntesis de dihidrotestosterona (DHT).
- Intervenciones Invasivas: En casos moderados a graves que no responden adecuadamente al tratamiento médico, se recurre a intervenciones invasivas. Históricamente, la resección transuretral de la próstata (RTUP) fue el estándar de oro. Sin embargo, han surgido alternativas buscando reducir la morbilidad y los costos asociados.
- Técnicas Alternativas:
- Ultrasonidos Enfocados de Alta Intensidad (HIFU): Emplea ultrasonidos para focalizar y destruir selectivamente el tejido prostático.
- Terapia con Láser Hipertermia: Utiliza láser para generar calor y tratar el exceso de tejido prostático.
- Electrovaporización Transuretral: Aplica energía eléctrica para vaporizar el exceso de tejido prostático.
- Ablación por Radiofrecuencia: Utiliza energía de radiofrecuencia para destruir el tejido prostático.
Estas técnicas emergentes buscan proporcionar opciones terapéuticas menos invasivas, minimizando la morbilidad y los costos asociados, y adaptándose así a las necesidades individuales de los pacientes con HBP sintomática. Este enfoque diversificado ofrece alternativas personalizadas para mejorar la calidad de vida de los afectados por esta condición.

Anatomía del hígado
 Síguenos en X: @el_homomedicus y @enarm_intensivo
APRENDER CIRUGÍA
Síguenos en X: @el_homomedicus y @enarm_intensivo
APRENDER CIRUGÍA