La acidosis metabólica es una alteración del equilibrio ácido-base en el cuerpo que se caracteriza principalmente por una disminución en la concentración de bicarbonato (HCO₃⁻) en suero. Esta condición se origina debido a dos mecanismos principales: la pérdida de bicarbonato o la ganancia de ácidos. El bicarbonato es un importante amortiguador que mantiene la estabilidad del pH sanguíneo, y su disminución provoca una caída del pH, lo que lleva a un estado de acidosis. Para detectar este tipo de alteraciones, los clínicos suelen utilizar el intervalo aniónico, que es una medida indirecta de la cantidad de aniones no medidos presentes en el suero.
El intervalo aniónico se calcula mediante la fórmula:
Intervalo aniónico = Na⁺ – (HCO₃⁻ + Cl⁻)
donde Na⁺ es la concentración de sodio, HCO₃⁻ es el bicarbonato y Cl⁻ es el cloruro en suero. Este cálculo es útil porque la diferencia entre los aniones medidos (bicarbonato y cloruro) y el sodio refleja la concentración de otros aniones no medidos que están presentes en el plasma. El intervalo aniónico normal en suero generalmente se encuentra entre 4 y 12 mEq/L, aunque muchos clínicos consideran un valor de referencia de 12 mEq/L. Es importante tener en cuenta que las diferencias en los métodos analíticos y los dispositivos de medición pueden influir en este valor.
El anión no medido más importante, responsable del incremento en el intervalo aniónico, es la albúmina. La albúmina, una proteína plasmática cargada negativamente, contribuye significativamente al balance de aniones en el cuerpo. La presencia de hipoalbuminemia (bajos niveles de albúmina en la sangre) puede alterar el intervalo aniónico y hacer que este se subestime. Por lo tanto, se ha propuesto que el intervalo aniónico debe corregirse en función de los niveles de albúmina sérica, con la siguiente fórmula:
Intervalo aniónico corregido en suero = (intervalo aniónico sérico medido) + (2.5 × [4.0 – albúmina sérica])
Este ajuste es necesario porque se estima que por cada disminución de 1 g/dL en la concentración de albúmina sérica, el intervalo aniónico disminuye en aproximadamente 2.5 mEq/L.
La interpretación del intervalo aniónico en el contexto de la acidosis metabólica puede proporcionar información valiosa sobre la causa subyacente de la alteración. En los casos de acidosis metabólica por ganancia de ácido, el intervalo aniónico suele aumentar. Esto se debe a que la adición de ácidos al cuerpo no solo reduce los niveles de bicarbonato, sino que también introduce aniones adicionales, como los ácidos orgánicos (por ejemplo, lactato, cetonas) o aniones relacionados con la acumulación de ácidos fuertes. El aumento en el intervalo aniónico refleja esta carga adicional de aniones no medidos, lo que sugiere una acidosis metabólica con «gap aniónico» elevado.
Por otro lado, en la acidosis metabólica no gap o hiperclorémica, el intervalo aniónico permanece normal. Este tipo de acidosis se caracteriza por una pérdida de bicarbonato, pero en su lugar, ocurre una retención de cloruro. En este escenario, la disminución de bicarbonato es compensada por un aumento en la concentración de cloruro (Cl⁻), lo que mantiene el intervalo aniónico dentro de los límites normales. Esto ocurre, por ejemplo, en situaciones de diarrea severa o en ciertos trastornos renales, donde la pérdida de bicarbonato se ve contrarrestada por un aumento en el cloruro plasmático.
Brecha aniónica en la acidosis metabólica
El concepto de intervalo aniónico o anion gap se utiliza en la medicina clínica como una herramienta para ayudar a identificar las causas subyacentes de la acidosis metabólica, un trastorno en el cual hay una acumulación de ácidos en el cuerpo o una pérdida significativa de bicarbonato. El intervalo aniónico es la diferencia entre las concentraciones de los cationes y aniones medidos en el suero, particularmente la diferencia entre el sodio y la suma del bicarbonato y el cloruro. Esta diferencia refleja la cantidad de aniones no medidos en la sangre, lo que es clave para comprender el origen de la acidosis.
En el contexto de la acidosis metabólica, se observa un aumento en el intervalo aniónico (superior a 12 mEq/L) en situaciones donde hay una acumulación de aniones no medidos que contribuyen a la acidosis. Entre las principales condiciones que inducen un aumento del intervalo aniónico se encuentran:
-
Cetoacidosis diabética: En este trastorno, la falta de insulina provoca la liberación de ácidos cetónicos, como el ácido acetoacético y el ácido beta-hidroxibutírico. Estos ácidos, que son aniones no medidos, aumentan el intervalo aniónico.
-
Cetoacidosis alcohólica: Similar a la cetoacidosis diabética, el abuso del alcohol puede inducir una cetogénesis excesiva, resultando en un aumento de los ácidos cetónicos en el cuerpo, los cuales contribuyen a un incremento en el intervalo aniónico.
-
Acidosis láctica: Se produce cuando hay una acumulación de lactato en la sangre debido a la falta de oxígeno, que puede ocurrir en condiciones como shock, sepsis o insuficiencia renal. El lactato es un anión que no se mide en los análisis estándar de sangre, por lo que su acumulación aumenta el intervalo aniónico.
-
Enfermedad renal crónica en etapas avanzadas: En la insuficiencia renal crónica, la acumulación de productos de desecho como el fosfato (PO₄³⁻) y el sulfato (SO₄²⁻) puede aumentar el intervalo aniónico, dado que estos son aniones no medidos que se acumulan cuando los riñones pierden su capacidad de excretarlos adecuadamente.
-
Cetoacidosis por inanición: La falta prolongada de ingesta calórica puede inducir la producción de cuerpos cetónicos como una fuente alternativa de energía, lo que lleva a un aumento en los ácidos cetónicos no medidos en la sangre y, por ende, al incremento del intervalo aniónico.
-
Intoxicación por drogas o productos químicos: Diversas sustancias químicas pueden inducir acidosis metabólica con un aumento del intervalo aniónico debido a la introducción de aniones adicionales en el cuerpo. Ejemplos notables incluyen la intoxicación por salicilatos (aspirina) y la exposición a sustancias como el metanol (que se convierte en ácido fórmico en el cuerpo) o el etilenglicol (que se metaboliza a ácido oxálico). Además, la intoxicación por paracetamol puede causar acidosis 5-oxoprolínica, lo que también eleva el intervalo aniónico.
Por otro lado, existen situaciones en las que el intervalo aniónico permanece dentro del rango normal (4–12 mEq/L) o incluso disminuye (por debajo de 6 mEq/L), a pesar de que el paciente pueda estar en acidosis metabólica. En estos casos, la causa de la acidosis se debe a la pérdida de bicarbonato o a un aumento de cloruro, sin que se acumulen aniones no medidos. Entre las causas de acidosis metabólica con un intervalo aniónico normal se encuentran:
-
Pérdida de bicarbonato: En condiciones como la diarrea severa, la pérdida de bicarbonato a través del tracto gastrointestinal es una causa común de acidosis metabólica sin un aumento en el intervalo aniónico. Lo mismo puede ocurrir en la pérdida de fluidos pancreáticos o en situaciones como la ileostomía no adaptada.
-
Recuperación de cetoacidosis diabética: Durante la fase de recuperación de la cetoacidosis diabética, el nivel de los ácidos cetónicos disminuye, y el intervalo aniónico puede retornar a niveles normales o casi normales a medida que el bicarbonato y el cloruro se equilibran.
-
Uso de inhibidores de la anhidrasa carbónica: Medicamentos como la acetazolamida, que inhiben la anhidrasa carbónica, pueden inducir una acidosis metabólica hiperclorémica sin aumentar el intervalo aniónico, ya que su acción genera retención de cloruro.
-
Acidosis tubular renal: En esta condición, los riñones no son capaces de excretar adecuadamente los ácidos, pero no se producen aniones adicionales que incrementen el intervalo aniónico. Esto da lugar a un aumento en los niveles de cloruro y a un intervalo aniónico normal.
-
Administración de ácido clorhídrico o amonio cloruro: La administración de soluciones que contengan estos compuestos puede aumentar la carga de cloruro en el cuerpo, equilibrando la pérdida de bicarbonato sin un aumento en el intervalo aniónico.
El intervalo aniónico también puede disminuir por hipoalbuminemia. La albúmina es el principal anión no medido en el plasma, y su disminución reduce la carga aniónica total, lo que puede hacer que el intervalo aniónico sea menor de lo esperado. Esto puede observarse en condiciones como enfermedades hepáticas crónicas, síndrome nefrótico o desnutrición severa. La corrección del intervalo aniónico en estos casos se puede realizar ajustando por la concentración de albúmina sérica, ya que se estima que por cada disminución de 1 g/dL en los niveles de albúmina, el intervalo aniónico disminuye en aproximadamente 2.5 mEq/L.
Acidosis metabólica con un intervalo aniónico elevado
La acidosis metabólica con un intervalo aniónico elevado es una condición secundaria a la adición de ácido al organismo, ya sea de origen exógeno o endógeno. En este trastorno, la acumulación de ácidos, en lugar de una pérdida de bicarbonato, es responsable de la disminución del pH sanguíneo y la alteración del equilibrio ácido-base. Las causas principales de esta acidosis incluyen la acidosis láctica, la cetoacidosis, las enfermedades renales y las intoxicaciones por diversas sustancias. Una manera útil de recordar los diagnósticos diferenciales de la acidosis metabólica con aumento del intervalo aniónico es mediante el acrónimo GOLDMARK, que hace referencia a los siguientes factores: glicoles (como el etilenglicol y el propilenglicol), oxoproline, lactato L, lactato D, metanol, intoxicación por salicilatos (aspirina), insuficiencia renal y cetoacidosis.
A. Acidosis Láctica
La acidosis láctica es una de las causas más comunes de la acidosis metabólica, y se caracteriza por un intervalo aniónico elevado y una disminución del pH sérico en ausencia de otros trastornos del equilibrio ácido-base. El lactato, el principal compuesto involucrado en esta condición, se forma a partir del piruvato durante la glucólisis anaeróbica, un proceso metabólico que ocurre cuando las células carecen de oxígeno suficiente para realizar la respiración celular normal. En condiciones fisiológicas, los niveles de lactato en sangre son bajos (alrededor de 1 mEq/L), ya que el lactato se metaboliza principalmente en el hígado a través de dos mecanismos: la gluconeogénesis, que convierte el lactato en glucosa, y la oxidación a través del ciclo de Krebs para producir energía.
En la acidosis láctica, sin embargo, los niveles de lactato en sangre aumentan significativamente, alcanzando valores de al menos 4–5 mEq/L y, en muchos casos, son mucho mayores. Esta acumulación excesiva de lactato es el resultado de un desequilibrio entre la producción y el metabolismo del lactato, lo que provoca la acidosis metabólica.
La acidosis láctica se clasifica en dos tipos principales:
-
Acidosis láctica tipo A (hipóxica): Este tipo es el más común y ocurre cuando hay una falta de oxígeno en los tejidos, lo que lleva a una producción elevada de lactato y una disminución de su metabolismo en el hígado. Las causas más frecuentes de acidosis láctica tipo A son el shock séptico, cardiogénico o hemorrágico, la isquemia mesentérica (falta de flujo sanguíneo en los intestinos), la insuficiencia respiratoria y la intoxicación por monóxido de carbono. En estos escenarios, la perfusión hepática se ve comprometida, lo que reduce la capacidad del hígado para metabolizar el lactato.
-
Acidosis láctica tipo B (no hipóxica): Este tipo de acidosis láctica ocurre en condiciones donde hay una disfunción en el uso del oxígeno dentro de las mitocondrias, las estructuras celulares encargadas de producir energía. Las causas de la acidosis láctica tipo B son diversas e incluyen causas metabólicas, como la diabetes mellitus, la enfermedad hepática, la insuficiencia renal, la deficiencia de tiamina, la acidosis láctica D (que ocurre en el síndrome de intestino corto) y algunas enfermedades hematológicas como la leucemia o el linfoma. También puede ser provocada por toxinas, entre las que se incluyen el etanol, el metanol, el etilenglicol, el cianuro, la isoniazida y la metformina.
Una de las causas menos conocidas de acidosis láctica tipo B es el uso de propilenglicol, una sustancia que se emplea como vehículo para la administración intravenosa de ciertos medicamentos, como nitroglicerina, etomidato y diazepam. El propilenglicol puede interferir con el metabolismo hepático y provocar una acumulación de lactato en el cuerpo, lo que genera acidosis metabólica.
La nutrición parenteral sin suficiente tiamina (una vitamina B necesaria para el metabolismo del piruvato) puede inducir una acidosis láctica refractaria, ya que el metabolismo del piruvato se ve alterado, lo que resulta en una acumulación de lactato. Este tipo de acidosis puede ser particularmente grave y resistente a los tratamientos convencionales.
Además, en algunas personas con síndrome de intestino corto debido a resección intestinal extensa, puede desarrollarse acidosis láctica D. En estos pacientes, la malabsorción de carbohidratos provoca fermentación bacteriana en el colon, lo que genera grandes cantidades de lactato D, que es una forma menos común de lactato que no es detectada por los métodos estándar de medición de lactato, ya que los ensayos tradicionales solo detectan la forma L. La acidosis láctica D se asocia con cambios neurológicos, como confusión, dificultad para hablar (disartria) y ataxia (dificultad para coordinar los movimientos).
B. Cetoacidosis
La cetoacidosis es una condición fisiológica comúnmente asociada con una deficiencia absoluta o relativa de insulina, lo que provoca un cambio en la fuente principal de energía del cuerpo de glucosa a la metabolización de ácidos grasos. En este estado, los ácidos grasos se descomponen en el hígado, produciendo cuerpos cetónicos. Los tres tipos principales de cuerpos cetónicos son: acetona, acetoacetato y beta-hidroxibutirato. La cetoacidosis metabólica se caracteriza por la acumulación de estos cuerpos cetónicos en la sangre, lo que da lugar a una disminución del pH sanguíneo y un aumento del intervalo aniónico. Este aumento se debe a la presencia de los cuerpos cetónicos, en particular el beta-hidroxibutirato y el acetoacetato, que son responsables del aumento del intervalo aniónico.
1. Cetoacidosis diabética
La cetoacidosis diabética (DKA, por sus siglas en inglés) es un tipo de cetoacidosis caracterizado por niveles elevados de glucosa en sangre y acidosis metabólica con un intervalo aniónico elevado. En la DKA, la deficiencia de insulina (ya sea absoluta o relativa) provoca un aumento en la liberación de glucagón, lo que lleva a la movilización de ácidos grasos desde los depósitos de grasa hacia el hígado, donde se convierten en cuerpos cetónicos. Esto ocurre debido a que la insulina, al ser insuficiente, no puede inhibir adecuadamente la lipólisis (la descomposición de las grasas). Los cuerpos cetónicos, especialmente el beta-hidroxibutirato y el acetoacetato, son los principales responsables del aumento del intervalo aniónico.
En la DKA, la acidosis metabólica se ve acompañada de un aumento en la producción de lactato debido a la hipoperfusión tisular, lo que contribuye a una acidosis láctica secundaria. La combinación de estos dos mecanismos – la cetoacidosis y la acidosis láctica – puede resultar en una disminución significativa del pH sanguíneo. El intervalo aniónico en la DKA es a menudo muy grande (superior a 20 mEq/L), pero su magnitud puede variar dependiendo de la severidad de la acidosis.
La elevación de la glucosa sérica conduce a una diuresis osmótica marcada, con pérdidas significativas de sodio, agua y potasio. El monitoreo de la corrección de la cetoacidosis se puede realizar a través de la medición de beta-hidroxibutirato sérico, del pH sanguíneo o mediante la normalización del intervalo aniónico. Aunque la medición de los cetonemia (cuerpos cetónicos en sangre) y la detección de cetonas urinarias a través de la prueba con nitroprusiato son útiles, la prueba de nitroprusiato solo detecta acetoacetato y acetona, no beta-hidroxibutirato. Por lo tanto, la medición directa de beta-hidroxibutirato sérico es preferible para monitorear la respuesta al tratamiento.
2. Cetoacidosis por ayuno
El ayuno prolongado puede inducir una respuesta fisiológica normal en la cual el hígado comienza a generar cuerpos cetónicos debido a una insuficiencia relativa de insulina. Esta respuesta es más evidente después de 12 a 14 horas de ayuno, alcanzando su pico entre las 20 y 30 horas. Aunque la cetosis es un proceso común durante el ayuno, la acidosis suele ser leve en estas condiciones. Sin embargo, la cetoacidosis manifiesta puede ocurrir en individuos que siguen dietas extremadamente bajas en carbohidratos, donde la producción de cuerpos cetónicos se vuelve más significativa debido a la restricción de glucosa.
3. Cetoacidosis alcohólica
La cetoacidosis alcohólica es una condición que afecta principalmente a personas crónicamente desnutridas que consumen grandes cantidades de alcohol. El metabolismo del alcohol disminuye la gluconeogénesis, lo que lleva a una producción hepática aumentada de beta-hidroxibutirato y, en menor grado, de acetoacetato. La cetoacidosis alcohólica también suele ir acompañada de trastornos mixtos de ácido-base, como una combinación de alcalosis metabólica debido a los vómitos y alcalosis respiratoria relacionada con el síndrome de abstinencia del alcohol, la aspiración o la cirrosis.
En el contexto tanto de cetoacidosis por ayuno como por alcohol, la liberación de insulina se ve suprimida por la hipoglucemia o por la estimulación del sistema nervioso simpático. Esta inhibición de la insulina permite la acumulación de cuerpos cetónicos, ya que la insulina normalmente inhibiría la lipólisis y la producción de cetonas. A pesar de la cetoacidosis, los pacientes con cetoacidosis alcohólica o por ayuno generalmente son capaces de producir insulina endógena suficiente, por lo que no requieren insulina exógena. El tratamiento inicial debe consistir en la administración de glucosa para estimular la liberación de insulina y suprimir la producción de cuerpos cetónicos. Es fundamental que el potasio se reponga antes de la administración de glucosa, ya que la liberación de insulina puede inducir un desplazamiento de potasio intracelular, lo que podría llevar a hipokalemia.
C. Toxinas
Diversas toxinas y fármacos son capaces de aumentar el intervalo aniónico en la acidosis metabólica, generalmente mediante la producción endógena de ácidos adicionales. Entre los ejemplos más comunes se incluyen el metanol, el etilenglicol y los salicilatos, que inducen la formación de ácidos específicos que contribuyen al aumento del intervalo aniónico.
-
Metanol: El metanol se metaboliza en el hígado por acción de la enzima alcohol deshidrogenasa, convirtiéndose en formaldehído, el cual se oxida a ácido fórmico. Este ácido es el principal responsable de la acidosis metabólica observada en la intoxicación por metanol. La acumulación de ácido fórmico aumenta el intervalo aniónico y puede llevar a un estado de acidosis grave. Los síntomas de intoxicación por metanol incluyen depresión del sistema nervioso central, dolor abdominal, y alteraciones visuales, que pueden evolucionar a ceguera permanente y acidosis metabólica severa si no se trata de manera oportuna.
-
Etilenglicol: El etilenglicol, al igual que el metanol, se metaboliza en el hígado, produciendo ácido glicólico y ácido oxálico. Estos metabolitos contribuyen significativamente a la acidosis metabólica y al aumento del intervalo aniónico. La intoxicación por etilenglicol se caracteriza por los efectos tóxicos sobre el sistema nervioso central, el corazón, y los riñones, siendo los cristales de oxalato en los riñones un signo distintivo de daño renal debido a la intoxicación.
-
Salicilatos: Los salicilatos, como la aspirina, pueden causar un trastorno mixto de acidosis metabólica con alcalosis respiratoria. En intoxicaciones agudas, los salicilatos aumentan la producción de ácido láctico y salicílico, lo que incrementa el intervalo aniónico. A medida que la intoxicación progresa, los efectos sobre el metabolismo celular pueden provocar una disminución de la capacidad del cuerpo para eliminar el ácido láctico, exacerbando la acidosis metabólica.
-
Tolueno: En la intoxicación por tolueno, el metabolito hippurato se excreta rápidamente por los riñones, lo que genera una acidosis metabólica, pero sin un aumento del intervalo aniónico, ya que el hippurato es un anión medido que se suma al cálculo del anión gap, por lo que no produce un incremento notable en este.
-
Isopropanol: El isopropanol se metaboliza en el cuerpo para formar acetona, lo que puede causar un aumento en la brecha osmolar, pero no en el intervalo aniónico. El aumento de la brecha osmolar es indicativo de la presencia de un soluto osmóticamente activo en el cuerpo (como la acetona), que no está reflejado en el intervalo aniónico, dado que no contribuye de manera significativa a la carga ácida.
-
Acetaminofén: El uso crónico de acetaminofén, incluso en dosis terapéuticas, puede provocar una acidosis metabólica con aumento del intervalo aniónico. Este efecto es causado por la acumulación de 5-oxoproline, un metabolito intermedio que se genera debido a la toxicidad del acetaminofén en el hígado. Aunque este fenómeno es relativamente raro, se ha observado en pacientes con uso prolongado de acetaminofén, particularmente en aquellos con disfunción hepática preexistente.
D. Acidosis Uremica
La acidosis uremica ocurre como consecuencia de la insuficiencia renal crónica, especialmente cuando la tasa de filtración glomerular (TFG) cae por debajo de los 15–30 mL/min/1.73 m². A medida que la función renal disminuye, los riñones se vuelven cada vez menos capaces de sintetizar amonio (NH₄⁺), lo cual es esencial para la excreción de hidrógeno (H⁺) en forma de cloruro de amonio (NH₄Cl). La disminución de la excreción de iones de hidrógeno, sumada a la acumulación de aniones orgánicos (como los fosfatos y sulfatos) que normalmente serían eliminados por los riñones, contribuye al desarrollo de una acidosis metabólica con aumento del intervalo aniónico.
En la insuficiencia renal avanzada, la acumulación de estos productos ácidos, junto con la incapacidad de los riñones para regular adecuadamente el equilibrio ácido-base, da lugar a un aumento del intervalo aniónico. Esto se debe a que los productos de desecho que se acumulan, como los fosfatos, sulfatos y otros aniones orgánicos, son no medidos por la prueba estándar de intervalo aniónico. De esta forma, el incremento del intervalo aniónico refleja la acumulación de estos compuestos en la sangre.
La acidosis uremica es uno de los trastornos más frecuentes en la insuficiencia renal avanzada y contribuye a diversas complicaciones metabólicas y fisiológicas. El tratamiento de esta acidosis generalmente incluye la corrección de los desequilibrios de líquidos y electrolitos, el uso de terapia de reemplazo renal (como hemodiálisis o diálisis peritoneal) para eliminar los productos tóxicos acumulados y el manejo adecuado de la función renal subyacente.
Acidosis Metabólica con Intervalo Aniónico Normal
La acidosis metabólica con intervalo aniónico normal, también conocida como acidosis metabólica hiperclorémica, se caracteriza por la pérdida de bicarbonato o una alteración en la capacidad renal para acidificar la orina, lo que provoca una acumulación de cloruro en la sangre, manteniendo la electroneutralidad del plasma. En este tipo de acidosis, el intervalo aniónico se mantiene dentro de los rangos normales, a diferencia de la acidosis metabólica con intervalo aniónico elevado, en la cual los aniones no medidos contribuyen al aumento del intervalo aniónico.
El mecanismo principal detrás de esta forma de acidosis metabólica es la pérdida de bicarbonato o defectos en la acidificación renal. En ambos casos, el cuerpo responde compensatoriamente con un aumento en los niveles de cloruro en suero (hipercloremia) para mantener el equilibrio de carga iónica, lo que resulta en un intervalo aniónico normal. A pesar de este ajuste compensatorio, la presencia de una acidosis metabólica sigue siendo significativa y requiere una identificación precisa de su causa subyacente.
A. Pérdida de Bicarbonato del Tracto Gastrointestinal
El tracto gastrointestinal es una de las principales fuentes de secreción de bicarbonato en el cuerpo, desempeñando un papel crucial en el mantenimiento del equilibrio ácido-base. Este ión es secretado en múltiples sitios a lo largo del tracto digestivo, especialmente en el estómago, el páncreas y el intestino delgado. La pérdida excesiva de bicarbonato desde el tracto gastrointestinal puede ser una de las causas primarias de acidosis metabólica con intervalo aniónico normal, también conocida como acidosis metabólica hiperclorémica.
Una de las causas más comunes de acidosis metabólica con intervalo aniónico normal debida a pérdida de bicarbonato es la diarrea. Durante un episodio de diarrea, el contenido intestinal se mueve rápidamente a través del intestino, lo que interfiere con la absorción de nutrientes y electrolitos, incluido el bicarbonato. Los fluidos fecales en la diarrea son ricos en bicarbonato, por lo que la evacuación excesiva de estos fluidos provoca una pérdida significativa de bicarbonato del organismo. La disminución del bicarbonato en el suero, que es esencial para mantener el equilibrio ácido-base, provoca una acidosis metabólica. Para contrarrestar esta pérdida, el cuerpo incrementa la concentración de cloruro en el suero para mantener la electroneutralidad, lo que resulta en una acidosis metabólica con un intervalo aniónico normal, dado que el aumento de cloruro compensa la disminución de bicarbonato, sin crear un cambio significativo en el cálculo del intervalo aniónico.
Aunque la diarrea es la causa más frecuente de pérdida de bicarbonato, existen otras situaciones menos comunes que también pueden inducir una acidosis metabólica con intervalo aniónico normal debido a la secreción excesiva de bicarbonato por el tracto gastrointestinal. Un ejemplo de esto es la ureterosigmoidostomía, un procedimiento quirúrgico en el cual los uréteres son implantados en el colon sigmoide para desviar la orina. En este caso, a diferencia de la vejiga, que es un órgano que almacena y elimina la orina, la mucosa del colon tiene la capacidad de secretar bicarbonato en un intercambio con cloruro. Este proceso de secreción de bicarbonato hacia el lumen del colon puede provocar una pérdida de bicarbonato en el cuerpo y contribuir a una acidosis metabólica. Aunque es un procedimiento menos frecuente, la ureterosigmoidostomía puede ser una causa importante de acidosis metabólica con intervalo aniónico normal en pacientes que han sido sometidos a este tipo de intervención quirúrgica.
En cuanto a las intervenciones quirúrgicas relacionadas con la derivación urinaria, la creación de una neovesícula urinaria mediante un segmento de intestino, generalmente del íleon o del colon, se ha vuelto una práctica más común que ha reducido considerablemente la incidencia de acidosis metabólica derivada de la desviación urinaria. Sin embargo, aunque esta práctica minimiza los efectos adversos sobre el equilibrio ácido-base, la acidosis metabólica aún puede ocurrir en algunos casos, especialmente cuando el contacto entre la orina y la mucosa intestinal es prolongado. Esto puede ocurrir típicamente en presencia de una estenosis anastomótica, que aumenta el tiempo de contacto entre la orina y la mucosa, favoreciendo la absorción de bicarbonato y contribuyendo a la pérdida del mismo.
B. Acidosis Tubular Renal
La acidosis tubular renal (ATR) se caracteriza por una acidosis metabólica hiperclorémica con un intervalo aniónico normal, que ocurre en ausencia de diarrea y con una tasa de filtración glomerular (TFG) normal o casi normal. Este trastorno se origina debido a defectos en los mecanismos de excreción de iones hidrógeno (H⁺) en los túbulos renales, lo que interfiere con la capacidad de los riñones para regular el equilibrio ácido-base de manera efectiva. En condiciones normales, los riñones son responsables de excretar los iones de hidrógeno en forma de amonio (NH₄⁺), lo que genera bicarbonato nuevo (HCO₃⁻) y ayuda a mantener el pH sanguíneo dentro de los rangos normales. En la ATR, este mecanismo se ve alterado, lo que conduce a la acumulación de ácidos en el cuerpo.
Existen tres tipos principales de acidosis tubular renal, los cuales se diferencian por el sitio específico del defecto en el riñón, así como por la clínica asociada, el pH urinario, el intervalo aniónico urinario y los niveles de potasio en suero.
1. Acidosis Tubular Renal Distal (Tipo I)
La acidosis tubular renal distal, también conocida como tipo I (dRTA), se caracteriza por una incapacidad del túbulo distal para excretar adecuadamente los iones de hidrógeno, lo que impide la acidificación completa de la orina. En este tipo de acidosis, a pesar de que el cuerpo experimenta acidosis sistémica, el pH de la orina permanece por encima de 5.5, lo que indica que no se está excretando suficiente ácido. Como resultado, la excreción de amonio en la orina también disminuye, y el intervalo aniónico urinario se vuelve positivo.
Este trastorno generalmente es secundario a una disminución congénita o adquirida en el número de bombas de hidrógeno funcionales en los túbulos distales, lo que reduce la capacidad de los riñones para secretar hidrógeno. Este defecto en la excreción de ácido provoca una acumulación de ácido en el cuerpo, lo que resulta en acidosis metabólica. A su vez, el bajo grado de acidosis y la alteración de los mecanismos de excreción de H⁺ en los riñones también afectan la secreción de potasio (K⁺), lo que puede llevar a hipokalemia. La hipokalemia es común en la dRTA debido a la mayor excreción de potasio que ocurre en respuesta a la falta de competencia entre el H⁺ y el K⁺ en el fluido tubular.
La acidosis tubular renal distal puede estar asociada con varias condiciones, incluyendo síndrome de Sjögren, lupus eritematoso sistémico (LES), mieloma múltiple, inhalación de tolueno (también conocida como «sniffing de pegamento»), enfermedad de Wilson y el uso de medicamentos como litio. En algunos casos, la dRTA puede ser provocada por la destrucción de la integridad tubular, como sucede con el uso del anfotericin B, un antifúngico que puede causar daño renal directo.
Un aspecto característico de la acidosis tubular renal distal es la alteración en el metabolismo óseo, como resultado de la liberación de bicarbonato y calcio desde los huesos para amortiguar el exceso de acidez en el cuerpo. Este proceso, aunque es una respuesta compensatoria ante la acidosis, conlleva a un aumento en la excreción de calcio en la orina (hipercalciuria), lo que puede predisponer a la formación de nefrólitos (cálculos renales). Además, se observa una disminución de citrato urinario, que normalmente actúa como inhibidor de la formación de cálculos, debido al aumento de su reabsorción en el túbulo proximal.
2. Acidosis Tubular Renal Proximal
La acidosis tubular renal proximal (tipo II) es un trastorno caracterizado por una alteración en la capacidad del túbulo proximal para reabsorber el bicarbonato filtrado. El bicarbonato es un electrolito clave en el mantenimiento del equilibrio ácido-base del cuerpo, y su reabsorción en los riñones es fundamental para prevenir la acidosis metabólica. En condiciones normales, el bicarbonato filtrado por el glomérulo es reabsorbido en el túbulo proximal, un proceso que ocurre a una tasa máxima determinada por el máximo tubular (Tm) para el bicarbonato. Este valor generalmente se encuentra entre 26 y 28 mEq/L en individuos sanos.
En la acidosis tubular renal proximal, se observa una disminución en el Tm para el bicarbonato, el cual típicamente desciende a valores entre 14 y 20 mEq/L. Esto implica que el túbulo proximal ya no puede reabsorber adecuadamente todo el bicarbonato filtrado, lo que da lugar a una pérdida urinaria de este electrolito. A diferencia de otros tipos de acidosis tubular renal, el defecto en la reabsorción de bicarbonato en el túbulo proximal se considera autolimitado, ya que los niveles de bicarbonato en suero dependen directamente de la gravedad del defecto en el túbulo proximal y de la capacidad del túbulo distal para reabsorber bicarbonato.
Este mecanismo crea un nuevo estado estable en el que los niveles de bicarbonato en suero son equivalentes al Tm, y el pH urinario sigue siendo ácido (ya que no se ve afectada la secreción de H⁺ en el túbulo distal). Además, el intervalo aniónico urinario es negativo debido a la preservación de la excreción de amonio, lo que indica que no hay alteración en los mecanismos de acidificación distal. La bicarbonaturia, o presencia de bicarbonato en la orina, solo ocurre cuando los niveles de bicarbonato en suero superan el Tm del túbulo proximal, lo que puede tener implicaciones terapéuticas importantes. Cuando esto sucede, la orina se vuelve más alcalina (con un pH mayor a 5.5), ya que el bicarbonato no puede ser completamente reabsorbido.
Un aspecto asociado a la acidosis tubular renal proximal es el síndrome de Fanconi, un trastorno en el cual no solo se ve afectada la reabsorción de bicarbonato, sino también otros procesos de reabsorción en el túbulo proximal. En el síndrome de Fanconi, los defectos de reabsorción afectan también a la glucosa (glucosuria), los aminoácidos (aminoaciduria), los fosfatos (fosfaturia) y el ácido úrico (uricosuria). Esta condición puede ser causada por una variedad de factores, siendo la toxicosis tubular proximal debida a las cadenas ligeras de inmunoglobulinas monoclonales en el mieloma múltiple la causa más común de acidosis tubular renal proximal.
Otras causas de la acidosis tubular renal proximal incluyen metales pesados, síndrome de Sjögren, cistinósis, enfermedad de Wilson y ciertos medicamentos como el acetazolamida, topiramato, tenofovir e ifosfamida. Estos agentes pueden dañar directamente las células tubulares proximales, alterando su capacidad para reabsorber bicarbonato.
Un aspecto importante a considerar en el tratamiento de la acidosis tubular renal proximal es que la aumento de la entrega de bicarbonato al túbulo distal, debido a la incapacidad del túbulo proximal para reabsorberlo, potencia la excreción de potasio (K⁺). Esto puede inducir hipokalemia, especialmente cuando se administra bicarbonato de sodio sin una adecuada suplementación de potasio. La corrección de la acidosis mediante la administración de bicarbonato requiere, por lo tanto, una vigilancia cuidadosa de los niveles de potasio en suero para evitar complicaciones asociadas a la disminución de este ion.
Además, al igual que en la acidosis tubular renal distal, la acidosis persistente en el tiempo puede tener efectos negativos en el metabolismo óseo. La acidosis crónica induce la liberación de calcio desde los huesos para contrarrestar la acidosis, lo que puede llevar a pérdida ósea. En los niños no tratados, esto puede llevar al desarrollo de raquitismo, mientras que en los adultos, la osteomalacia (blandecimiento de los huesos) puede ser una complicación importante.
A diferencia de la acidosis tubular renal distal, la nefrólitiasis (formación de cálculos renales) es menos común en la acidosis tubular renal proximal. Esto se debe a que en este tipo de acidosis, se produce un aumento en la excreción de citrato urinario, que tiene un efecto protector sobre la formación de cálculos al aumentar la solubilidad del calcio en la orina. Este aumento en el citrato urinario disminuye la probabilidad de que se formen depósitos de calcio, lo que protege al paciente de la formación de cálculos renales.
3. Acidosis Tubular Renal Hiporeninémica Hiperalosteronémica (Tipo IV)
La acidosis tubular renal hiporeninémica hiperalosteronémica (Tipo IV) es la forma más común de acidosis tubular renal observada en la práctica clínica. Esta condición se caracteriza principalmente por la hiperpotasemia (niveles elevados de potasio en sangre) secundaria a una disminución en la producción de aldosterona, lo que altera varios mecanismos de homeostasis ácido-base y de equilibrio de electrolitos en el organismo.
La aldosterona, una hormona producida por las glándulas suprarrenales, juega un papel clave en la regulación del equilibrio de sodio y potasio en el cuerpo. Su acción se ejerce principalmente a nivel de los túbulos distales del riñón, donde promueve la excreción de potasio en la orina y la reabsorción de sodio. Además, la aldosterona también favorece la secreción de hidrógeno (H⁺), lo que es crucial para mantener el equilibrio ácido-base.
Cuando hay una disminución de la aldosterona, ya sea por una hiporreninemia (bajos niveles de renina) o por una resistencia a la acción de la aldosterona en los túbulos renales, la capacidad de los riñones para secretar potasio y protones se ve comprometida. Esto da lugar a un aumento en los niveles plasmáticos de potasio (hiperpotasemia) y una acumulación de ácido en el organismo, lo que conduce a una acidosis metabólica no aniónica (sin aumento en el intervalo aniónico) o acidosis metabólica hiperclorémica.
El trastorno ácido-base que caracteriza a la acidosis tubular renal hiporeninémica hiperalosteronémica se manifiesta como una acidosis metabólica con hiperpotasemia y sin un aumento significativo en el intervalo aniónico (lo que la diferencia de otras formas de acidosis metabólica). Esta acidosis se asocia con un pH urinario normal o bajo, lo que indica que los mecanismos de excreción de hidrógeno en los túbulos distales no están funcionando adecuadamente debido a la falta de aldosterona.
Los pacientes con esta condición suelen presentar síntomas relacionados con la hiperpotasemia, como debilidad muscular, fatiga, y alteraciones en el ritmo cardíaco (arritmias), debido a los efectos directos del potasio elevado sobre el sistema cardiovascular y neuromuscular.
Las causas más frecuentes de la acidosis tubular renal hiporeninémica hiperalosteronémica incluyen la nefropatía diabética y las enfermedades tubulointersticiales renales, las cuales afectan la función renal a largo plazo y alteran la producción y/o acción de la aldosterona. En estos pacientes, el daño renal crónico interfiere con la respuesta normal a la aldosterona y con los mecanismos de excreción de potasio y protones, lo que da lugar a la acidosis y la hiperpotasemia características de este trastorno.
Además de las afecciones subyacentes, varios medicamentos pueden empeorar la hiperpotasemia y la acidosis en estos pacientes. Inhibidores de la enzima convertidora de angiotensina (IECA), bloqueadores de los receptores de angiotensina II (ARA II), espironolactona (un medicamento diurético ahorrador de potasio) y antiinflamatorios no esteroides (AINEs) pueden reducir aún más la producción de aldosterona o interferir con su acción, exacerbando la acumulación de potasio y la acidosis. Estos fármacos son conocidos por su efecto sobre la función renal y el equilibrio de electrolitos, lo que los convierte en factores de riesgo adicionales para el desarrollo de esta forma de acidosis tubular renal.
En el contexto de una disminución en la producción de aldosterona o de resistencia a su acción, los riñones se ven incapaces de secretar cantidades adecuadas de protones (H⁺) y potasio (K⁺) en la orina. Como consecuencia, el equilibrio ácido-base se desplaza hacia la acidosis metabólica, y los niveles elevados de potasio en sangre (hiperpotasemia) se mantienen debido a una menor excreción de este electrolito. Este trastorno se caracteriza por la ausencia de un aumento significativo en el intervalo aniónico, lo que lo distingue de otras formas de acidosis metabólica, como aquellas asociadas con una ganancia de ácidos no volátiles, en las que el intervalo aniónico suele ser elevado.
El tratamiento de la acidosis tubular renal hiporeninémica hiperalosteronémica se enfoca principalmente en corregir la hiperpotasemia y mejorar el equilibrio ácido-base. El manejo incluye el uso de agentes que promuevan la excreción de potasio y la administración de bicarbonato para contrarrestar la acidosis. Sin embargo, es esencial ajustar cuidadosamente el tratamiento, ya que los pacientes con esta condición tienen una susceptibilidad aumentada a la hipokalemia debido a la administración excesiva de bicarbonato o fármacos que aumenten la excreción renal de potasio.
Además, en pacientes con nefropatía diabética o enfermedades tubulointersticiales renales, es crucial controlar la causa subyacente, como optimizar el control de la glucosa en sangre en los pacientes diabéticos o tratar las afecciones renales crónicas subyacentes. Los medicamentos que afectan la producción de aldosterona, como los inhibidores de la enzima convertidora de angiotensina o los bloqueadores de los receptores de angiotensina, deben ser utilizados con precaución en estos pacientes para evitar la exacerbación de la acidosis y la hiperpotasemia.
C. Otras Causas de Acidosis No Aniónica
La acidosis no aniónica se refiere a situaciones de acidosis metabólica en las que no se observa un aumento significativo en el intervalo aniónico, lo que implica que la acumulación de ácidos no volátiles no está relacionada con ácidos no medidos que aumentan el anión gap. Hay varias causas posibles de esta forma de acidosis, además de las ya descritas en los trastornos renales, y una de las principales es la acidosis por dilución, que ocurre cuando se expande rápidamente el volumen extracelular con soluciones salinas normales. Este fenómeno tiene implicaciones clínicas importantes, ya que puede inducir un desequilibrio en la homeostasis ácido-base.
1. Acidosis por Dilución
Una acidosis por dilución puede ocurrir cuando el volumen extracelular es incrementado rápidamente con solución salina normal, que contiene sodio, pero carece tanto de bicarbonato como de sales de sodio que puedan ser metabolizadas para generar bicarbonato. Esta falta de bicarbonato en la solución salina no favorece la compensación habitual del metabolismo ácido-base, por lo que la acidosis puede persistir sin una corrección natural de los niveles de hidrógeno. Esto genera una acidosis metabólica en la que la solución administrada diluye los componentes iónicos en la sangre, lo que puede disminuir la concentración de bicarbonato sin modificar otros electrolitos. La preocupación sobre el uso de soluciones salinas normales ha aumentado debido a que, en algunos casos, la expansión rápida del volumen con esta solución puede inducir efectos adversos, como edema o un desequilibrio ácido-base persistente. En la práctica clínica, se tiende a utilizar soluciones cristalinas equilibradas, como la solución de Ringer lactato, que contienen electrolitos en proporciones que ayudan a mantener el equilibrio ácido-base. Sin embargo, los datos sobre cuál es la mejor opción de fluido para cada situación clínica siguen siendo contradictorios y aún no se han establecido recomendaciones universales.
2. Uso del Anión Gap Urinario
Cuando se enfrenta a una acidosis metabólica, la respuesta renal normal es aumentar la excreción de ammonium (NH₄Cl) para ayudar a eliminar el exceso de protones (H⁺) en el cuerpo. La excreción urinaria de ammonium puede aumentar considerablemente, desde aproximadamente 30 mEq por día en condiciones normales hasta 200-300 mEq por día en respuesta a la acidosis. Una manera de evaluar esta excreción es a través del anión gap urinario, que se calcula utilizando la siguiente ecuación:
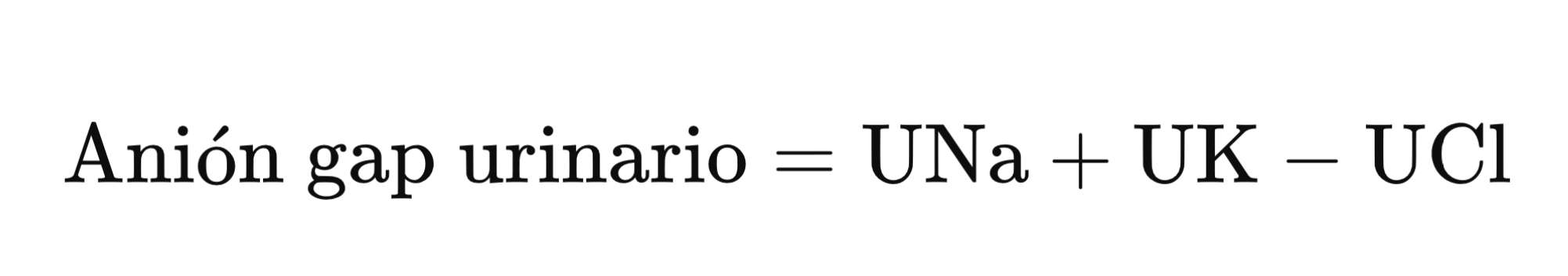
Este cálculo permite diferenciar entre causas gastrointestinales (GI) y renales de acidosis hiperclorémica. En el caso de pérdida de bicarbonato por el tracto gastrointestinal, como ocurre con la diarrea, la acidificación renal permanece intacta y la excreción de NH₄Cl aumenta adecuadamente, lo que resulta en un anión gap urinario negativo. Por el contrario, en el caso de una acidosis tubular renal distal (dRTA), la excreción de ammonium está alterada, lo que lleva a un anión gap urinario positivo. En la acidosis tubular renal proximal (pRTA, Tipo II), el principal problema es la deficiencia en la reabsorción de bicarbonato, lo que genera una mayor excreción de bicarbonato en lugar de una disminución en la excreción de NH₄Cl. Como resultado, el anión gap urinario en pRTA a menudo será negativo hasta que se inicie un tratamiento con bicarbonato exógeno.
3. Uso del Gap Osmolar Urinario
En algunas situaciones clínicas, como cuando se encuentran grandes cantidades de otros aniones en la orina, por ejemplo, hipurato en la intoxicación por tolueno o beta-hidroxibutirato y acetoacetato en la cetoacidosis, el anión gap urinario puede no ser fiable. En estos casos, el gap osmolar urinario puede ser un indicador más útil para estimar la excreción de NH₄⁺. El gap osmolar urinario se calcula con la siguiente fórmula:
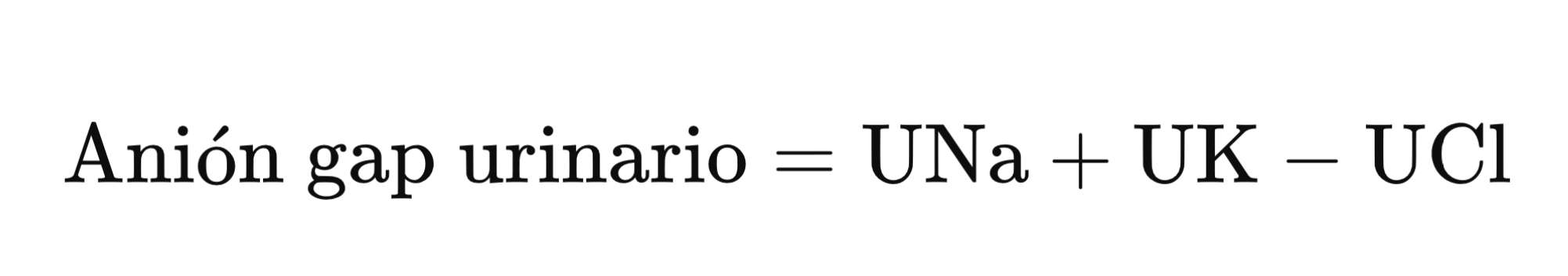
Donde Uosm es la osmolalidad urinaria total. En este caso, un gap osmolar urinario menor a 150 mOsmol/kg sugiere una excreción deficiente de ammonium y, por lo tanto, una respuesta renal alterada a la acidosis. En cambio, un gap osmolar urinario superior a 400 mOsmol/kg indica una respuesta renal intacta a la acidosis. Este marcador puede ser útil especialmente cuando el anión gap urinario no es confiable debido a la presencia de aniones que interfieren con su medición.
Manifestaciones clínicas
Los síntomas de la acidosis metabólica están principalmente relacionados con la enfermedad subyacente que la causa, y pueden variar considerablemente dependiendo de la etiología. Sin embargo, existen manifestaciones comunes que ayudan a los profesionales de la salud a identificar este trastorno y evaluar su gravedad.
Una de las respuestas fisiológicas más importantes ante la acidosis metabólica es la hiperventilación compensatoria. El cuerpo, al detectar el aumento de ácidos en la sangre, trata de corregir el desequilibrio ácido-base elevando la eliminación de dióxido de carbono (CO₂) a través de la respiración. Este proceso se realiza mediante un aumento en la frecuencia y profundidad de la respiración, lo cual disminuye los niveles de dióxido de carbono en la sangre, un ácido volátil que contribuye a la acidosis. Esta hiperventilación es una respuesta compensatoria normal del organismo para contrarrestar la acidosis, y es un signo clínico importante de que el cuerpo está intentando corregir el pH sanguíneo.
Sin embargo, la hiperventilación en respuesta a la acidosis metabólica puede ser malinterpretada como un trastorno respiratorio primario, ya que la respiración rápida y profunda puede ser un síntoma común de varias enfermedades pulmonares. Este fenómeno respiratorio puede adoptar la forma de respiración de Kussmaul, que se caracteriza por respiraciones profundas, regulares y a menudo rítmicas, acompañadas de un sonido similar a un suspiro. La respiración de Kussmaul se observa principalmente en casos de acidosis metabólica grave, como la cetoacidosis diabética o la acidosis láctica, y es indicativa de un intento intenso del cuerpo para eliminar el exceso de CO₂.
La respiración de Kussmaul no solo es un mecanismo compensatorio para disminuir la acidez en la sangre, sino también un indicador clínico de la severidad de la acidosis metabólica. Su presencia en un paciente, junto con otras características clínicas, como confusión, debilidad y letargo, puede sugerir un trastorno metabólico grave que requiere atención médica urgente. En algunos casos, la respiración de Kussmaul puede ser tan pronunciada que parece una respiración respiratoria primaria, lo que puede dificultar la identificación de la causa subyacente, si no se tiene en cuenta el contexto clínico del paciente.
Es importante señalar que los síntomas respiratorios de la acidosis metabólica, especialmente la hiperventilación, pueden variar dependiendo de la causa subyacente de la acidosis. En acidosis metabólica leve, la compensación respiratoria puede ser insuficiente para causar un cambio significativo en la frecuencia respiratoria o la profundidad de la respiración, mientras que en formas más graves, la respiración de Kussmaul puede ser prominente. Además, la interpretación del cuadro clínico debe tener en cuenta que el paciente podría no solo tener acidosis metabólica, sino también otras alteraciones que interfieren con la respiración.
Exámenes diagnósticos
En la acidosis metabólica, el pH sanguíneo disminuye debido a la acumulación de ácidos no volátiles (por ejemplo, ácidos láctico o cetoacético) o por una pérdida significativa de bicarbonato, que es un tampón clave para mantener la homeostasis del pH. Esta reducción del pH es la característica principal de la acidosis y refleja un aumento de la concentración de iones de hidrógeno (H⁺) en el plasma. Un pH sanguíneo por debajo de los 7.35 se considera indicativo de acidosis.
La disminución del bicarbonato sérico (HCO₃⁻) es una característica esencial de la acidosis metabólica. El bicarbonato es un importante amortiguador en el cuerpo que ayuda a neutralizar los ácidos, y su reducción contribuye directamente a la disminución del pH. En la acidosis metabólica, la pérdida de bicarbonato puede ser el resultado de diversos mecanismos, tales como la excreción renal inadecuada de bicarbonato, la pérdida gastrointestinal de bicarbonato o la producción excesiva de ácidos no volátiles. El cuerpo intenta contrarrestar esta pérdida mediante varios mecanismos compensatorios, como la hiperventilación, con el fin de eliminar el dióxido de carbono (CO₂) de la sangre y, así, reducir la acidez.
El Pco₂ también tiende a disminuir en la acidosis metabólica debido a la compensación respiratoria. El cuerpo responde al aumento de la concentración de iones de hidrógeno mediante un aumento en la frecuencia y profundidad de la respiración, lo que facilita la eliminación de CO₂, un ácido volátil. Esta reducción del CO₂ en la sangre ayuda a contrarrestar parcialmente la disminución del bicarbonato y restablecer el equilibrio ácido-base, aunque de forma incompleta.
El intervalo aniónico es una medida que refleja la concentración de aniones no medidos en el suero sanguíneo. En la acidosis metabólica, este parámetro puede ser normal o aumentado, dependiendo de la causa subyacente del trastorno.
En los casos de acidosis metabólica hiperclorémica (también conocida como acidosis metabólica con intervalo aniónico normal), el trastorno generalmente se debe a la pérdida de bicarbonato, como ocurre en la diarrea o en ciertas condiciones renales. En estos casos, se observa un aumento compensatorio de los niveles de cloruro (Cl⁻) en el suero, lo que mantiene el intervalo aniónico dentro de los valores normales, aunque el pH sanguíneo sigue estando disminuido debido a la pérdida de bicarbonato.
En cambio, cuando la acidosis metabólica es causada por la ganancia de ácidos no volátiles (como en la acidosis láctica o la cetoacidosis diabética), el intervalo aniónico suele aumentar, ya que los ácidos añadidos (por ejemplo, lactato o cuerpos cetónicos) contribuyen a un aumento en la carga aniónica no medida, elevando el valor del intervalo aniónico.
La hiperpotasemia, o niveles elevados de potasio en sangre, es otro hallazgo común en la acidosis metabólica. Esto se debe a varios mecanismos. Primero, en un entorno ácido, los iones de hidrógeno (H⁺) tienden a entrar en las células para disminuir la concentración extracelular de ácidos. Para mantener el equilibrio eléctrico, el potasio (K⁺) se desplaza fuera de las células hacia el espacio extracelular, lo que resulta en un aumento de los niveles séricos de potasio. Además, la disminución de la función renal en algunos tipos de acidosis metabólica puede comprometer la excreción adecuada de potasio, lo que agrava aún más la hiperpotasemia.
La hiperpotasemia puede ser peligrosa, ya que aumenta el riesgo de arritmias cardíacas y puede tener efectos graves sobre la función muscular y nerviosa. En el contexto de la acidosis metabólica, la corrección del trastorno ácido-base y la normalización de los niveles de potasio son prioridades clave en el tratamiento.
Tratamiento
El tratamiento de la acidosis metabólica depende en gran medida del tipo específico de acidosis presente, y se centra en abordar la causa subyacente y en la corrección de los desequilibrios ácido-base. En el caso de la acidosis con aumento del intervalo aniónico, que es un trastorno causado por la acumulación de ácidos no volátiles o la pérdida de bicarbonato, y la acidosis con intervalo aniónico normal, que generalmente resulta de la pérdida de bicarbonato o defectos en la acidificación renal, se utilizan enfoques terapéuticos diferentes.
A. Tratamiento de la acidosis con aumento del intervalo aniónico
El tratamiento de la acidosis con aumento del intervalo aniónico se enfoca principalmente en el tratamiento de la causa subyacente. Por ejemplo, en el contexto de la cetoacidosis diabética, se administra insulina para corregir la deficiencia de insulina y fluidos intravenosos para restaurar la perfusión tisular y corregir los déficits de volumen. En la acidosis láctica, la terapia se orienta a tratar la causa subyacente de la hipoxia o disfunción celular, y en las intoxicaciones por productos como metanol o etilenglicol, el tratamiento incluye la administración de antídotos adecuados.
En cuanto al tratamiento específico de la acidosis metabólica, el uso de bicarbonato de sodio (NaHCO₃) es controvertido. Aunque en algunas situaciones de acidosis grave, con un pH arterial inferior a 7.1–7.2, el NaHCO₃ puede ser necesario para estabilizar al paciente, su uso en grandes cantidades tiene efectos adversos potenciales. El bicarbonato de sodio administrado en grandes cantidades puede inducir hipernatremia, hiperosmolaridad, sobrecarga de volumene incluso empeorar la acidosis intracelular, ya que el sodio adicional puede alterar el equilibrio de fluidos y la regulación ácida en las células. Por lo tanto, el tratamiento con bicarbonato de sodio se reserva para casos más graves y, generalmente, se monitoriza de cerca para evitar efectos indeseables.
B. Tratamiento de la acidosis con intervalo aniónico normal (acidosis hiperclorémica)
En la acidosis con intervalo aniónico normal, que se observa típicamente en la acidosis tubular renal (ATR), el tratamiento se enfoca en la corrección de los defectos metabólicos y en la prevención de complicaciones a largo plazo, como la nefrocalcinosis y la progresión a enfermedad renal crónica (ERC).
En los casos de ATR proximal (pRTA), el tratamiento principal consiste en la administración de alcalinos como el bicarbonato o el citrato. Estos compuestos ayudan a corregir el déficit de bicarbonato y a restaurar el equilibrio ácido-base. En pacientes con pRTA, se pueden requerir dosis relativamente altas de alcalinos (10–15 mEq/kg/día), ya que una parte del bicarbonato administrado se excreta en la orina. Este tratamiento puede llevar a la exacerbación de la hipokalemia, por lo que a menudo se utiliza una mezcla de sales de sodio y potasio para evitar o corregir la deficiencia de potasio.
El tratamiento de la acidosis tubular renal distal (dRTA) tipo I requiere menos alcalinos (generalmente 1–2 mEq/kg/día), pero los pacientes con dRTA a menudo también necesitan suplementos de potasio, ya que la excreción de potasio se ve aumentada debido al fallo en la excreción de protones en el túbulo distal. En algunos casos, el tratamiento con bicarbonato de sodio debe ajustarse para equilibrar las concentraciones de sodio y potasio en el cuerpo.
Para la acidosis tubular renal tipo IV (RTA tipo IV), que generalmente se caracteriza por una disminución de la producción de aldosterona y una acumulación de potasio, el tratamiento incluye la restricción dietética de potasio, especialmente en pacientes con insuficiencia renal y en aquellos que están tomando medicamentos que pueden exacerbar la hiperpotasemia, como los inhibidores de la enzima convertidora de angiotensina (IECA), bloqueadores de los receptores de angiotensina II (ARA-II), espironolactona y antiinflamatorios no esteroideos (AINEs). La retirada de los fármacos que retienen potasio es una medida clave en estos casos.
El tratamiento también puede incluir el uso de diuréticos de asa como la furosemida, que ayudan a aumentar la excreción de potasio y agua, reduciendo así la hiperpotasemia y el volumen circulante. En algunos casos, el fludrocortisona, un mineralocorticoide, puede ser eficaz para estimular la excreción renal de potasio sin causar una expansión significativa del volumen. En estos pacientes, también puede ser necesario administrar bicarbonato por vía oral (1–2 mEq/kg/día) para corregir la acidosis metabólica, especialmente si los niveles de potasio están controlados.

Fuente y lecturas recomendadas:
- Fenves AZ et al. Approach to patients with high anion gap metabolic acidosis: Core Curriculum 2021. Am J Kidney Dis. 2021; 78:590. [PMID: 34400023]
- Giglio S et al. Distal renal tubular acidosis: a systematic approach from diagnosis to treatment. J Nephrol. 2021;34:2073. [PMID: 33770395]
- Palmer BF et al. Electrolyte and acid-base disturbances in patients with diabetes mellitus. N Engl J Med. 2015;373:548. [PMID: 26244308]
- Palmer BF et al. Salicylate toxicity. N Engl J Med. 2020;382:2544. [PMID: 32579814]
Originally posted on 21 de marzo de 2025 @ 11:53 PM





