El hipotiroidismo es un trastorno endocrino común, que afecta aproximadamente al 0.3 % de la población con manifestaciones clínicas evidentes. Se presenta de manera desproporcionada en mujeres, quienes representan alrededor del 85 % de los casos diagnosticados. Esta enfermedad se caracteriza por una deficiencia de las hormonas tiroideas, las cuales son fundamentales para el funcionamiento normal de casi todos los sistemas del cuerpo. La gravedad del hipotiroidismo varía considerablemente, desde formas leves y clínicamente silentes, hasta casos severos que culminan en mixedema, una forma extrema de hipotiroidismo que puede poner en riesgo la vida.
Durante el embarazo, el hipotiroidismo materno puede tener consecuencias significativas para el desarrollo neurológico fetal. Estudios han demostrado que los hijos de madres con hipotiroidismo no tratado durante la gestación tienen un coeficiente intelectual promedio siete puntos menor en comparación con los hijos de madres con función tiroidea normal. En el caso del hipotiroidismo congénito, su incidencia es de aproximadamente uno por cada 4,000 nacimientos. Si no se diagnostica y trata oportunamente, este trastorno puede derivar en cretinismo, una condición caracterizada por retraso cognitivo permanente y otras alteraciones del desarrollo.
El hipotiroidismo puede clasificarse según su etiología en dos grandes categorías: hipotiroidismo primario, cuando el defecto se localiza en la glándula tiroides misma, ya sea por falla funcional o por extirpación quirúrgica; y hipotiroidismo secundario, cuando la deficiencia hormonal es consecuencia de una insuficiencia en la secreción de la hormona estimulante de la tiroides (TSH) por parte de la hipófisis.
La causa más frecuente de hipotiroidismo es la tiroiditis autoinmune, también conocida como enfermedad de Hashimoto. En algunos casos, el hipotiroidismo puede ser transitorio, como ocurre en la tiroiditis subaguda de origen viral (tiroiditis de De Quervain), que inicialmente se manifiesta con una fase de hipertiroidismo antes de evolucionar hacia una fase hipotiroidea.
La presencia de bocio, es decir, el agrandamiento de la glándula tiroides, puede observarse en diversas condiciones que afectan el metabolismo tiroideo. Entre estas se incluyen la tiroiditis, la deficiencia de yodo, defectos genéticos enzimáticos tiroideos, exposición a alimentos bociógenos en regiones con escasa disponibilidad de yodo (como nabos o yuca), y enfermedades infiltrativas como el cáncer o la sarcoidosis. Además, varios medicamentos pueden inducir bocio e hipotiroidismo, como el yoduro, el propiltiouracilo, el metimazol, las sulfonamidas, la amiodarona, el interferón alfa y beta, la interleucina-2 y el litio. Este último, por ejemplo, induce bocio detectable por ecografía en aproximadamente el 50 % de los pacientes que lo consumen a largo plazo.
No obstante, el bocio puede estar ausente en casos de tiroiditis autoinmune o cuando el tejido tiroideo ha sido destruido por radioterapia dirigida al cuello, a la región torácica, o por terapia con yodo radiactivo (I-131). La tiroidectomía total inevitablemente conlleva hipotiroidismo, mientras que en pacientes sometidos a hemitiroidectomía, alrededor del 22 % desarrollan hipotiroidismo posterior.
La amiodarona, debido a su alto contenido de yodo, puede causar hipotiroidismo clínicamente significativo en el 15 al 20 % de los pacientes que la reciben, y también puede inducir tirotoxicosis. El hipotiroidismo por amiodarona es más común en personas con tiroiditis autoinmune preexistente. En estos pacientes, la concentración sérica de tiroxina (T4) suele estar baja o en el límite inferior de lo normal, mientras que la concentración de TSH está notablemente elevada, generalmente por encima de 20 mUI/L. Cerca del 17 % de los pacientes tratados con amiodarona presentan una elevación de TSH sin síntomas y con niveles normales de T4, lo que permite un manejo expectante sin necesidad inmediata de tratamiento con levotiroxina.
El exceso de yodo en la dieta también puede precipitar hipotiroidismo, especialmente en individuos con predisposición autoinmune, como aquellos con tiroiditis linfocítica. En casos raros, ciertos tumores malignos pueden inducir un tipo de hipotiroidismo denominado “hipotiroidismo consumptivo”, mediante la sobreexpresión de la enzima desyodasa tipo 3, la cual inactiva las hormonas tiroideas. Este fenómeno ha sido documentado en hemangiomas grandes y en neoplasias con alta carga tumoral como el cáncer de colon, el carcinoma basocelular, los tumores fibrosos y los tumores del estroma gastrointestinal (GIST).
Por otra parte, algunos agentes quimioterapéuticos pueden causar tiroiditis silente que evoluciona hacia hipotiroidismo. Entre ellos se encuentran los inhibidores de tirosina quinasa, denileukin diftitox, alemtuzumab, interferón alfa, interleucina-2, talidomida, lenalidomida y los inhibidores de puntos de control inmunitarios. Este tipo de tiroiditis suele comenzar con una fase de hipertiroidismo poco reconocida, seguida de hipotiroidismo.
Otras terapias, como la radioterapia con radionúclidos dirigida (RAI), también pueden inducir hipotiroidismo. El uso de mifepristona se asocia con hipotiroidismo primario, además de aumentar los requerimientos de hormona tiroidea exógena. Por su parte, el mitotano puede causar hipotiroidismo secundario al afectar la función hipofisaria.
Manifestaciones clínicas
El hipotiroidismo, especialmente en sus formas leves, frecuentemente pasa desapercibido debido a la inespecificidad de sus manifestaciones clínicas. En muchos casos, los síntomas son sutiles, se desarrollan de manera insidiosa y se confunden con el envejecimiento o con otras condiciones médicas comunes. Las manifestaciones clínicas derivan de la disminución generalizada en el metabolismo celular, consecuencia directa de la deficiencia de hormonas tiroideas, las cuales son fundamentales para la regulación de múltiples funciones fisiológicas.
En el hipotiroidismo leve, los pacientes suelen presentar síntomas vagos y no específicos. Entre los más frecuentes se encuentran el aumento de peso sin cambios proporcionales en la ingesta calórica, fatiga persistente, letargo, depresión, debilidad generalizada y disnea al realizar esfuerzos moderados. También son comunes las mialgias, artralgias, calambres musculares, sangrado menstrual abundante (menorragia), estreñimiento y sequedad cutánea. Otros síntomas incluyen cefalea, parestesias, intolerancia al frío, síndrome del túnel carpiano y fenómeno de Raynaud.
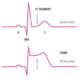
En el examen físico pueden observarse signos como bradicardia, hipertensión arterial predominantemente diastólica, uñas delgadas y quebradizas, alopecia o afinamiento del cabello, edema periférico, cara y párpados hinchados, y palidez cutánea que puede adquirir un tinte amarillento debido a la acumulación de caroteno (carotenemia). Uno de los hallazgos neurológicos característicos, aunque no exclusivo, es la relajación retardada de los reflejos tendinosos profundos. En muchos casos, se palpa un bocio, consecuencia de la hiperestimulación tiroidea por niveles elevados de la hormona estimulante de la tiroides (TSH), o bien como resultado de la enfermedad tiroidea de base.
Algunas manifestaciones clínicas son menos frecuentes, pero también forman parte del espectro del hipotiroidismo. Estas incluyen pérdida de apetito con adelgazamiento, disfonía, disminución del sentido del gusto y del olfato, así como hipoacusia. En pacientes con bocio de gran tamaño, puede haber disfagia o sensación de presión o incomodidad en el cuello. Aunque lo más habitual en mujeres en edad fértil es la menorragia, algunas presentan hipomenorrea o incluso amenorrea.
En el examen físico se pueden detectar signos menos comunes como pérdida de pestañas y vello de las cejas (especialmente del tercio externo), engrosamiento de la lengua, edema duro y depresible, y derrames en cavidades serosas como el espacio pleural, peritoneal y en las articulaciones. La galactorrea, aunque poco frecuente, puede presentarse debido al aumento en los niveles de prolactina secundaria a la disfunción hipotalámica-hipofisaria inducida por el hipotiroidismo.
En casos prolongados o severos, puede desarrollarse cardiomegalia, a veces denominada «corazón mixedematoso», así como derrames pericárdicos. En situaciones extremas, puede aparecer psicosis franca, conocida como “locura mixedematosa”, que puede ser desencadenada tanto por el hipotiroidismo severo como por la toxicidad de medicamentos cuyo metabolismo se enlentece en el contexto de la disfunción tiroidea.
Es importante destacar que algunos pacientes con tiroiditis autoinmune, principal causa de hipotiroidismo, presentan síntomas que no derivan del déficit hormonal, sino de enfermedades autoinmunes asociadas. Estas pueden incluir enfermedad de Addison, hipoparatiroidismo, diabetes mellitus tipo 1, anemia perniciosa, síndrome de Sjögren, vitiligo, cirrosis biliar primaria, sensibilidad al gluten y enfermedad celíaca. El reconocimiento de estas comorbilidades es crucial, ya que su manejo requiere un abordaje integral más allá del tratamiento de la disfunción tiroidea.
Exámenes diagnósticos
El método diagnóstico más eficaz y sensible para la detección del hipotiroidismo es la determinación sérica de la hormona estimulante de la tiroides, conocida como TSH. Esta prueba es particularmente útil debido a la forma en que el eje hipotálamo-hipófisis-tiroides regula los niveles de hormonas tiroideas. En el hipotiroidismo primario, la glándula tiroides no produce cantidades adecuadas de hormonas tiroideas, lo que genera una respuesta compensatoria por parte de la hipófisis, que incrementa la secreción de TSH en un intento por estimular la glándula tiroidea disfuncional. Este aumento en los niveles de TSH es, por lo tanto, un marcador temprano y altamente sensible de hipotiroidismo primario. Simultáneamente, las concentraciones de tiroxina libre (FT4) en suero se encuentran disminuidas o en el límite inferior del rango normal, lo que refuerza el diagnóstico.
El rango de referencia para la TSH, medido mediante técnicas ultrasensibles, se sitúa generalmente entre 0.4 y 4.0 miliunidades internacionales por litro (mIU/L). Sin embargo, este rango puede variar con la edad, siendo común que los niveles basales de TSH se eleven de manera fisiológica en personas mayores, lo que debe considerarse al interpretar los resultados.
Además del aumento de TSH y la disminución de FT4, el hipotiroidismo puede producir diversas alteraciones bioquímicas. Entre estas se encuentran la hipoglucemia y distintos tipos de anemia, que pueden ser normocíticas o macrocíticas, dependiendo de la etiología subyacente y del estado nutricional del paciente. La hiponatremia también es frecuente, y suele deberse al síndrome de secreción inadecuada de hormona antidiurética (SIADH) o a una disminución de la tasa de filtración glomerular, ambos mecanismos influenciados por la disminución del metabolismo sistémico inducida por el déficit hormonal.
Desde el punto de vista del perfil lipídico y hepático, los pacientes con hipotiroidismo a menudo presentan elevaciones en los niveles séricos de colesterol de baja densidad (LDL), triglicéridos y lipoproteína(a), así como elevaciones de las enzimas hepáticas y de la creatina quinasa. También es común encontrar niveles elevados de prolactina, debido a una mayor secreción de hormona liberadora de tirotropina (TRH) por el hipotálamo, que estimula tanto la TSH como la prolactina en la hipófisis.
En pacientes con tiroiditis autoinmune, que representa la causa más frecuente de hipotiroidismo primario, los títulos de autoanticuerpos contra la peroxidasa tiroidea (TPO) y la tiroglobulina (TG) suelen estar elevados. También puede detectarse la presencia de anticuerpos antinucleares (ANA), aunque estos rara vez indican la coexistencia de lupus eritematoso sistémico; su presencia más bien refleja una activación general del sistema inmune.
El hipotiroidismo subclínico es una entidad diagnóstica en la que los niveles séricos de tiroxina libre permanecen dentro del rango normal, mientras que la TSH se encuentra elevada. Esta condición es especialmente prevalente en personas mayores de 65 años, con una incidencia aproximada del 13 % en esta población. Es importante señalar que, a pesar del nombre, el término «subclínico» se refiere únicamente a los parámetros bioquímicos y no necesariamente a la ausencia de síntomas. De hecho, muchos pacientes con hipotiroidismo subclínico pueden presentar síntomas compatibles con hipofunción tiroidea. En aproximadamente el 60 % de los casos, los niveles elevados de TSH se normalizan de manera espontánea en el transcurso de cinco años, especialmente en aquellos pacientes sin anticuerpos antitiroideos detectables y con elevaciones leves de TSH.
En cuanto al diagnóstico por imágenes, este rara vez es necesario para confirmar el hipotiroidismo. No obstante, en ciertos casos, estudios por tomografía computarizada (TC) o resonancia magnética (RM) pueden revelar la presencia de bocio en la región cervical o en el mediastino, especialmente cuando se trata de bocios retroesternales. En pacientes con tiroiditis autoinmune, puede observarse un timo agrandado, reflejo de la activación inmunitaria. En la resonancia magnética cerebral, también puede observarse una glándula hipófisis agrandada, lo cual se debe a la hiperplasia de las células productoras de TSH en respuesta a la falta de retroalimentación negativa por parte de las hormonas tiroideas.
Diagnóstico diferencial
El diagnóstico diferencial del hipotiroidismo subclínico, definido bioquímicamente por una concentración sérica elevada de hormona estimulante de la tiroides (TSH) con niveles normales de tiroxina libre (FT4), o bien por una FT4 baja sin elevación de TSH, requiere una evaluación cuidadosa para evitar diagnósticos erróneos y tratamientos innecesarios. Este estado no siempre refleja una disfunción tiroidea primaria real y puede deberse a una variedad de condiciones fisiológicas, patológicas o incluso interferencias analíticas.
Uno de los factores que puede generar resultados anómalos en la medición de TSH es la interferencia por anticuerpos heterófilos o antianimal que interfieren con los inmunoensayos. Estas interferencias pueden provocar una falsa elevación de TSH sin correlación clínica. Otra fuente de error es la presencia de macro-TSH, una forma de la hormona que se encuentra complejada con inmunoglobulinas, lo que prolonga su vida media y puede hacer que se detecte como falsamente elevada sin que exista hipotiroidismo real.
Ciertos estados fisiológicos también pueden alterar temporalmente el eje hipotálamo-hipófisis-tiroides. Por ejemplo, la privación del sueño, el ejercicio intenso, la recuperación tras una enfermedad no tiroidea (también conocida como síndrome del eutiroideo enfermo) y las emergencias psiquiátricas agudas pueden provocar elevaciones transitorias de la TSH o reducciones leves de la FT4, sin que ello indique disfunción tiroidea estructural. Estos cambios suelen ser adaptativos y reversibles, reflejando una priorización metabólica durante estados de estrés sistémico.
El síndrome del eutiroideo enfermo merece una mención especial. Esta entidad se presenta en individuos con enfermedad sistémica grave, sometidos a cirugía mayor o bajo restricción calórica severa, en quienes se observa una disminución de FT4 y triyodotironina (T3), sin una elevación compensatoria de la TSH. La supresión de TSH en estos contextos se debe a una inhibición central transitoria del eje hipotalámico-hipofisario, como respuesta al estado catabólico o inflamatorio sistémico. En estos casos, no está indicado el tratamiento con levotiroxina, ya que las alteraciones hormonales no reflejan un verdadero hipotiroidismo, sino una adaptación fisiológica al estado de enfermedad crítica.
El diagnóstico del hipotiroidismo primario concurrente en el contexto de enfermedad no tiroidea severa puede ser particularmente complejo, ya que la TSH puede estar suprimida debido al estado sistémico, lo que enmascara una falla tiroidea subyacente. La presencia de un bocio palpable o antecedentes sugestivos de enfermedad tiroidea autoinmune pueden orientar al diagnóstico en estos casos.
En situaciones en las que tanto la FT4 como la TSH están bajas, el clínico debe considerar la posibilidad de hipotiroidismo secundario, es decir, debido a una insuficiencia hipofisaria o hipotalámica. Sin embargo, este diagnóstico es poco probable en pacientes sin antecedentes sugestivos de lesiones centrales, traumatismos craneales, cirugía hipofisaria, radioterapia o enfermedades del sistema nervioso central. En otras palabras, no es común que una persona previamente sana desarrolle hipopituitarismo agudo sin señales clínicas que lo precedan.
En pacientes críticamente enfermos que presentan hiponatremia, hipoglucemia, hipotensión o signos compatibles con insuficiencia hipofisaria, y en quienes no se puede descartar hipopituitarismo, puede ser razonable iniciar tratamiento empírico con levotiroxina, especialmente si existen datos que sugieren una enfermedad central, como diabetes insípida, hipogonadismo, o lesiones del sistema nervioso central. No obstante, esta decisión debe ser cuidadosamente evaluada en función del contexto clínico global.
Complicaciones
Las complicaciones del hipotiroidismo, especialmente cuando es severo o de larga evolución, pueden ser numerosas y potencialmente graves. Estas derivan de la disminución prolongada de las hormonas tiroideas, las cuales son esenciales para la homeostasis metabólica de prácticamente todos los órganos y sistemas del cuerpo. Cuando esta deficiencia no se corrige oportunamente, el organismo puede desarrollar alteraciones multisistémicas que van mucho más allá de los síntomas clásicos de fatiga y ganancia de peso.
Desde el punto de vista inmunológico y respiratorio, los pacientes con hipotiroidismo avanzado presentan una mayor susceptibilidad a infecciones bacterianas, en particular a la neumonía, debido a la reducción en la actividad del sistema inmunitario y a un reflejo tusígeno debilitado. Además, se ha descrito el desarrollo de megacolon, una complicación gastrointestinal rara, pero grave, atribuida al enlentecimiento extremo de la motilidad intestinal. Asimismo, la infertilidad puede ser una consecuencia directa del hipotiroidismo crónico, dada su interferencia con la ovulación, el eje hipotalámico-hipofisario-gonadal y el metabolismo de las hormonas sexuales.
En el ámbito psiquiátrico, uno de los cuadros más llamativos es la psicosis orgánica conocida como “locura mixedematosa” (myxedema madness), en la que los pacientes desarrollan síntomas paranoides, alucinaciones o delirios. Este fenómeno se atribuye a la disfunción cerebral inducida por el hipometabolismo generalizado del sistema nervioso central. A nivel muscular, puede presentarse rabdomiólisis, una condición en la que ocurre destrucción del tejido muscular, con liberación de mioglobina al torrente sanguíneo, lo que puede desencadenar insuficiencia renal aguda.
Durante el embarazo, el hipotiroidismo no tratado se asocia a un alto riesgo de complicaciones, incluyendo aborto espontáneo, preeclampsia, parto prematuro y deterioro en el desarrollo neurocognitivo del feto. Estas complicaciones se deben a la importancia crítica de las hormonas tiroideas para el desarrollo fetal temprano, particularmente en el sistema nervioso central.
Por otra parte, el inicio del tratamiento con levotiroxina en pacientes con enfermedad cardiovascular establecida, como cardiopatía isquémica o insuficiencia cardíaca, debe realizarse con precaución, ya que el aumento en el metabolismo inducido por las hormonas tiroideas puede desenmascarar o agravar estas condiciones. En casos excepcionales, puede incluso precipitar una crisis adrenal en individuos con insuficiencia suprarrenal no diagnosticada, al acelerar el metabolismo del cortisol y agravar su deficiencia.
Una de las complicaciones más graves del hipotiroidismo es la crisis mixedematosa, una condición potencialmente mortal caracterizada por la exacerbación extrema de los síntomas hipotiroideos. Esta entidad clínica afecta predominantemente a mujeres (alrededor del 80 % de los casos), y el 94 % de los pacientes presentan hipotiroidismo primario. Notablemente, en aproximadamente la mitad de los casos, la enfermedad no había sido previamente diagnosticada. Una causa común de esta crisis es la suspensión del tratamiento con levotiroxina, ya sea por olvido, falta de adherencia o problemas de acceso a la medicación.
La crisis mixedematosa también puede desencadenarse de forma espontánea en pacientes hipotiroideos expuestos de manera prolongada al frío, lo que produce hipotermia. Otros factores precipitantes incluyen accidentes cerebrovasculares, insuficiencia cardíaca, infecciones graves (especialmente neumonía), traumatismos, y el uso de fármacos depresores del sistema nervioso central, como sedantes, antidepresivos, hipnóticos, anestésicos u opioides. El metabolismo de estos fármacos se encuentra enlentecido en el contexto del hipotiroidismo, lo cual potencia su toxicidad, particularmente a nivel cognitivo y respiratorio. Esta combinación de hipoventilación, deterioro del estado mental y depresión del centro respiratorio puede conducir al paro respiratorio.
Desde el punto de vista clínico, todos los pacientes con crisis mixedematosa presentan algún grado de alteración del estado de conciencia, que puede oscilar desde una somnolencia leve hasta el coma profundo. Por esta razón, el término “coma mixedematoso” es considerado inadecuado, ya que no todos los pacientes se encuentran comatosos. Adicionalmente, pueden presentarse convulsiones y signos neurológicos centrales anómalos. Entre las alteraciones bioquímicas y fisiológicas más frecuentes se encuentran la hiponatremia (presente en aproximadamente el 65 % de los casos), la hipotermia (50 %), la hipotensión (40 %), la bradicardia (20 %), la hipoglucemia (15 %), la rabdomiólisis y la insuficiencia renal aguda.
La mortalidad de la crisis mixedematosa es elevada, incluso con tratamiento adecuado, y refleja la gravedad del estado de descompensación metabólica en estos pacientes. Por ello, el reconocimiento temprano y el manejo intensivo en unidades de cuidados críticos son fundamentales para mejorar el pronóstico.
Tratamiento
El tratamiento del hipotiroidismo requiere un enfoque integral que comience con una evaluación clínica minuciosa, ya que el inicio de la terapia con hormonas tiroideas puede descompensar condiciones subyacentes no diagnosticadas. En particular, es fundamental descartar la presencia de insuficiencia suprarrenal o enfermedad coronaria, ya que ambas condiciones pueden agravarse significativamente con la administración de levotiroxina. En pacientes con insuficiencia suprarrenal no tratada, la aceleración del metabolismo inducida por las hormonas tiroideas puede precipitar una crisis adrenal. De igual forma, en pacientes con enfermedad coronaria o arritmias, el aumento en la demanda metabólica miocárdica puede desencadenar angina, infarto o descompensación cardíaca.
En el caso del hipotiroidismo subclínico, la decisión de iniciar tratamiento con levotiroxina depende de múltiples factores. Está claramente indicado en mujeres que buscan embarazo, dado el papel crucial de las hormonas tiroideas en el desarrollo fetal temprano. También se recomienda en adultos jóvenes de hasta 30 años, en quienes una disfunción tiroidea sostenida puede tener repercusiones a largo plazo, así como en pacientes con concentraciones séricas de TSH superiores a 20 mIU/L o con síntomas clínicos compatibles con hipotiroidismo. En ausencia de estos criterios, el tratamiento no es imprescindible, aunque se debe mantener una vigilancia clínica y bioquímica periódica para detectar la aparición de síntomas o progresión del trastorno.
Tratamiento del hipotiroidismo manifiesto
La levotiroxina sintética es el tratamiento de elección para el hipotiroidismo. Esta hormona, análoga a la tiroxina endógena (T4), permite restablecer los niveles hormonales adecuados y revertir progresivamente los síntomas clínicos. Las formulaciones genéricas han demostrado ser bioequivalentes a las de marca, de acuerdo con los estándares de la Agencia de Alimentos y Medicamentos de los Estados Unidos. En situaciones especiales, como en pacientes hospitalizados o con deterioro neurológico severo, existen presentaciones liofilizadas de levotiroxina que permiten la administración por vía intravenosa.
Algunos médicos aún utilizan preparados desecados de tiroides porcina, que contienen tanto tiroxina (T4) como triyodotironina (T3), bajo marcas como Armour Thyroid, NatureThroid o NP Thyroid. Aunque estos productos son preferidos por ciertos pacientes, diversas sociedades médicas desaconsejan su uso debido a la dificultad para ajustar sus dosis y a la variabilidad en su contenido hormonal. Un grano (equivalente a 65 mg) de tiroides desecada corresponde aproximadamente a 100 microgramos de levotiroxina.
En adultos jóvenes y de mediana edad sin comorbilidades, se puede iniciar el tratamiento con una dosis promedio de 1.6 microgramos por kilogramo de peso corporal al día. Esta dosis puede ajustarse según la severidad del hipotiroidismo, siendo menores en casos leves y completas en cuadros más sintomáticos. El objetivo terapéutico inicial es normalizar la concentración sérica de TSH, lo cual suele alcanzarse tras 3 a 4 semanas de tratamiento. Aunque tradicionalmente la levotiroxina se administra en la mañana, la administración nocturna puede resultar en niveles séricos de T4 más altos y TSH más bajos; sin embargo, se recomienda mantener el horario de administración constante para evitar fluctuaciones.
Durante el embarazo, el hipotiroidismo manifiesto o la crisis mixedematosa deben tratarse de inmediato con dosis completas de levotiroxina, dada la urgencia de asegurar un ambiente hormonal adecuado para el feto. En pacientes mayores de 60 años o con cardiopatía isquémica estable, se recomienda comenzar con dosis menores, entre 25 y 50 microgramos diarios, y ajustar progresivamente cada 1 a 3 semanas hasta alcanzar la eutiroxinemia.
En presencia de crisis mixedematosa, el tratamiento requiere una reposición hormonal agresiva. Se puede iniciar con una dosis de carga de 500 microgramos de levotiroxina intravenosa, seguida de 50 a 100 microgramos diarios, dependiendo del riesgo cardiovascular del paciente. En algunos casos, especialmente en pacientes inconscientes con hipoventilación, puede añadirse liotironina (T3), la forma activa de la hormona tiroidea, con un bolo inicial de 10–20 microgramos, seguido de dosis adicionales cada 8–12 horas durante las primeras 48 horas.
El tratamiento de soporte en la crisis mixedematosa es igualmente fundamental. Los pacientes con hipotermia deben ser calentados de forma pasiva con mantas, ya que el calentamiento rápido puede inducir colapso cardiovascular. La hipoglucemia se corrige con soluciones intravenosas de dextrosa al 5 %. Ante hiponatremia, se debe considerar la posibilidad de insuficiencia adrenal. Para su evaluación, se miden niveles de glucosa y triglicéridos, ya que la hiponatremia dilucional es frecuente. Deben evitarse fármacos y soluciones intravenosas hipotónicas que agraven el desequilibrio. Pacientes levemente sintomáticos con niveles de sodio entre 120 y 129 mEq/L se tratan con restricción de líquidos, salvo que estén deshidratados. Si hay síntomas neurológicos, deben ser hospitalizados para manejo intensivo.
Los pacientes con hipoventilación o hipercapnia requieren asistencia mecánica para la ventilación. En estos casos, debe evitarse el uso de opioides o administrarlos en dosis mínimas, dado su potencial depresor del centro respiratorio. Toda infección debe tratarse de manera agresiva, especialmente si se sospecha neumonía, que es una causa frecuente de descompensación. Ante la sospecha de insuficiencia suprarrenal concomitante, se administra hidrocortisona intravenosa a dosis de 100 mg iniciales, seguidos de 25 a 50 mg cada 6 a 8 horas.
Monitoreo y optimización del tratamiento del hipotiroidismo
El monitoreo regular y la optimización del tratamiento del hipotiroidismo son pilares fundamentales para garantizar la efectividad y seguridad de la terapia con levotiroxina. Este seguimiento permite no solo alcanzar la eutiroxinemia, sino también adaptarse a los cambios fisiológicos del paciente, detectar fallos en la absorción del fármaco, identificar problemas de adherencia terapéutica y ajustar las dosis ante situaciones clínicas específicas.
Tras iniciar el tratamiento con levotiroxina, se debe realizar una vigilancia estrecha mediante determinaciones mensuales de la hormona estimulante de la tiroides (TSH), tiroxina libre (T4 libre) y triyodotironina libre (T3 libre). El objetivo inicial es normalizar la TSH en un plazo de aproximadamente dos meses, lo cual indica una adecuada reposición hormonal. La restauración del estado eutiroideo clínico se logra usualmente manteniendo estos tres parámetros dentro de sus rangos de referencia. Este enfoque permite evaluar no solo el efecto periférico de la levotiroxina (a través de la T4 y T3 libres), sino también la respuesta hipofisaria (a través de la TSH), que es más sensible a cambios hormonales sutiles.
Durante el embarazo, se produce un aumento significativo en los requerimientos de levotiroxina, el cual puede evidenciarse tan temprano como en la quinta semana de gestación. Esta necesidad se debe al incremento en la globulina transportadora de tiroxina, a la transferencia de hormona al feto, y al aumento en el metabolismo materno. Después del parto, las necesidades de levotiroxina generalmente regresan a los niveles previos a la gestación. Asimismo, los requerimientos pueden disminuir en mujeres posmenopáusicas, tras una ooforectomía bilateral, con la interrupción del tratamiento con estrógenos orales, o durante el uso de agonistas de la hormona liberadora de gonadotropina.
1. Elevación de la TSH sérica:
En la mayoría de los casos, una TSH elevada sugiere una dosis insuficiente de levotiroxina. No obstante, la falta de adherencia al tratamiento es una causa sorprendentemente frecuente de esta situación. Por lo tanto, antes de aumentar la dosis, es imprescindible confirmar que el paciente está tomando el medicamento de forma adecuada. En pacientes con cardiopatía isquémica o fibrilación auricular recurrente, puede ser prudente mantener la TSH en el rango alto-normal, e incluso ligeramente elevada, para evitar efectos adversos sobre el sistema cardiovascular.
La levotiroxina debe ingerirse en ayunas, por la mañana, con agua sola, ya que su absorción se ve comprometida por múltiples factores. Diversas condiciones gastrointestinales como gastritis atrófica o síndromes de malabsorción pueden interferir en su biodisponibilidad. Además, ciertos fármacos o sustancias como hierro, fibra, raloxifeno, sucralfato, antiácidos con aluminio, resinas secuestradoras de ácidos biliares, inhibidores de bomba de protones, calcio, magnesio, leche, café y leche de soya pueden reducir significativamente su absorción.
Asimismo, algunos medicamentos como los estrógenos orales o aquellos que inducen enzimas hepáticas pueden aumentar la necesidad de levotiroxina. Amiodarona, por su contenido elevado en yodo y su efecto en la desyodación periférica, puede tanto aumentar como disminuir los requerimientos de levotiroxina. En situaciones de enfermedad psiquiátrica aguda, en recuperación de enfermedades no tiroideas o con el uso de antipsicóticos, puede observarse una elevación transitoria de la TSH. Además, ciertas enfermedades autoinmunes pueden interferir con los inmunoensayos hormonales, generando falsos positivos.
2. TSH en rango normal:
El objetivo terapéutico habitual es mantener la TSH dentro del rango bajo-normal (0.4 a 2.0 mIU/L). No obstante, incluso con una TSH normal, algunos pacientes presentan síntomas persistentes de hipotiroidismo. Estudios han mostrado que estos individuos tratados tienden a tener niveles más altos de colesterol LDL, una tasa metabólica basal más baja y niveles reducidos de T3 sérica en comparación con sujetos eutiroideos. Esto puede explicar por qué, pese a tener una TSH normal, siguen manifestando fatiga, lentitud cognitiva, o intolerancia al frío.
Ante estos casos, es esencial descartar otras causas subyacentes de sintomatología similar, como efectos adversos farmacológicos, enfermedad de Addison, anemia, hipogonadismo, depresión, sensibilidad al gluten, enfermedad celíaca u otras enfermedades autoinmunes. Si estas condiciones han sido excluidas o adecuadamente tratadas, y los síntomas persisten, la medición de T3 total o libre puede ser útil. Niveles bajos de T3 pueden reflejar una actividad inadecuada de la desyodinasa periférica encargada de convertir T4 en T3. En tales pacientes, se puede considerar un aumento leve de la dosis de levotiroxina —siempre que no exista contraindicación como angina inestable—, con el objetivo de alcanzar niveles séricos de T3 libre en la mitad inferior del rango de referencia y aliviar los síntomas, incluso si ello implica una ligera supresión de la TSH.
3. TSH baja o suprimida:
Una TSH por debajo del rango de referencia (<0.4 mIU/L) puede dividirse en baja (0.1–0.39 mIU/L) o suprimida (<0.1 mIU/L). En pacientes clínicamente eutiroideos que presentan TSH ligeramente baja, no se ha observado un aumento en la morbilidad. Sin embargo, una TSH suprimida generalmente indica una dosis excesiva de levotiroxina, situación que puede incrementar el riesgo de fibrilación auricular, osteoporosis, y signos clínicos de hipertiroidismo.
En el diagnóstico diferencial de una TSH suprimida deben considerarse otras condiciones como hipopituitarismo, enfermedades sistémicas severas no tiroideas y el uso de ciertos medicamentos. En ausencia de estas condiciones, lo apropiado es reducir la dosis de levotiroxina. No obstante, algunos pacientes que experimentan síntomas marcados de hipotiroidismo al recibir una dosis reducida, y que presentan niveles bajos de T3, pueden beneficiarse de restablecer la dosis previa o bien utilizar preparados de tiroides desecada. En estos casos, es fundamental una monitorización estrecha debido al riesgo de hipertiroidismo subclínico, arritmias y pérdida ósea.
Pronóstico
La evolución de los pacientes con hipotiroidismo depende en gran medida de la causa subyacente, la severidad de la condición y la respuesta al tratamiento. El hipotiroidismo leve, especialmente el que es causado por la tiroiditis autoinmune, generalmente tiene un pronóstico relativamente favorable en cuanto a la remisión. En estos casos, aproximadamente el 11% de los pacientes pueden experimentar una remisión espontánea de la enfermedad, lo que significa que la función tiroidea se normaliza sin la necesidad de intervención médica prolongada. Sin embargo, este fenómeno es poco frecuente y, a menudo, se ve asociado con fluctuaciones en la función tiroidea a lo largo del tiempo. La remisión puede ser más común en etapas tempranas de la enfermedad, pero la progresión hacia un hipotiroidismo permanente puede ocurrir en muchos pacientes debido al daño autoinmune continuo sobre la glándula tiroides.
Por otro lado, el tratamiento con levotiroxina, la terapia estándar para el hipotiroidismo, permite que la mayoría de los pacientes alcancen un estado clínico normal. La normalización de los niveles de hormonas tiroideas mediante la administración de levotiroxina generalmente lleva a una mejora sustancial de los síntomas, como la fatiga, la depresión y el aumento de peso, restaurando así la calidad de vida. Sin embargo, es importante destacar que la interrupción del tratamiento con levotiroxina puede desencadenar un resurgimiento de los síntomas de hipotiroidismo, incluso en aquellos pacientes que previamente se encontraban en un estado eutiroideo. Esto refleja la naturaleza crónica de la enfermedad subyacente, que generalmente requiere tratamiento de por vida para mantener el control de los niveles hormonales.
El pronóstico de los pacientes que experimentan una crisis mixedematosa es considerablemente más grave. La crisis mixedematosa, una manifestación aguda y potencialmente fatal del hipotiroidismo severo, se caracteriza por la aparición de síntomas graves como hipoventilación, hipotermia, bradicardia, hiponatremia y disfunción multiorgánica. En estos casos, la mortalidad es elevada, con tasas que varían entre el 30% y el 100%, dependiendo de la gravedad de los síntomas y la prontitud con la que se inicie el tratamiento adecuado. Los pacientes con síntomas más graves y aquellos que no reciben tratamiento oportuno tienen un riesgo significativamente mayor de morir, lo que subraya la importancia de la intervención médica rápida y efectiva en estos casos. El tratamiento adecuado, que incluye la administración intravenosa de levotiroxina y el manejo de complicaciones asociadas como la hiponatremia y la hipotermia, puede mejorar notablemente las probabilidades de supervivencia, aunque la mortalidad sigue siendo alta en los casos más críticos.


Fuente y lecturas recomendadas:
- Biondi B et al. Critical approach to hypothyroid patients with persistent symptoms. J Clin Endocrinol Metab. 2023;108:2708. [PMID: 37071856]
- Bridwell RE et al. Decompensated hypothyroidism: a review for the emergency clinician. Am J Emerg Med. 2021;39:207. [PMID: 33039222]
- Chaudhary S et al. Utility of myxedema score as a predictor of mortality in myxedema coma. J Endocrinol Invest. 2022;46:59. [PMID: 35945394]
- Ross DS. Treating hypothyroidism is not always easy: when to treat subclinical hypothyroidism, TSH goals in the elderly, and alternatives to levothyroxine monotherapy. J Intern Med. 2022;291:128. [PMID: 34766382]
- Salvatore D et al. The relevance of T3 in the management of hypothyroidism. Lancet Diabetes Endocrinol. 2022;10:366. [PMID: 35240052]
Originally posted on 27 de abril de 2025 @ 8:53 AM