El Primate erythroparvovirus 1, más comúnmente conocido como parvovirus B19, es un virus de ADN monocatenario perteneciente a la familia Parvoviridae que presenta un marcado tropismo por las células precursoras eritroides humanas, especialmente aquellas localizadas en la médula ósea. Esta afinidad se debe principalmente a la expresión del receptor celular globósido (antígeno P) en dichas células, el cual es esencial para la entrada del virus. Una vez que el parvovirus B19 se une a este receptor, puede penetrar la célula y utilizar su maquinaria para replicarse, lo que lleva a la lisis de las células infectadas y a la interrupción temporal de la eritropoyesis.
La infección por parvovirus B19 es altamente prevalente en la población general. Se estima que aproximadamente el 50% de los niños ya presentan anticuerpos IgG contra el virus hacia los 15 años de edad, lo que indica una infección previa. La transmisión del virus ocurre a través de diversas vías, siendo las más comunes las secreciones respiratorias y la saliva, lo que explica su diseminación especialmente en ambientes escolares y comunitarios. Además, existe transmisión vertical transplacentaria, lo cual puede afectar al feto, particularmente si la madre no tiene inmunidad previa; se estima que entre un 30% y 50% de las mujeres embarazadas son susceptibles. Otra vía significativa de contagio es la transfusión de productos sanguíneos contaminados, dado que el virus puede resistir ciertos procesos de inactivación.
El período de incubación del parvovirus B19 oscila entre 4 y 14 días, tras lo cual puede manifestarse con un espectro clínico variable, desde infecciones subclínicas hasta cuadros sintomáticos como el eritema infeccioso (también conocido como «quinta enfermedad»), crisis aplásicas transitorias en pacientes con hemopatías crónicas, y artritis o artralgias en adultos. En individuos inmunocomprometidos, el virus puede causar infecciones crónicas, caracterizadas por una eritropoyesis ineficaz persistente y anemia crónica.
Cabe mencionar que otro miembro del mismo género viral, el bocavirus, también pertenece al grupo de los eritroparvovirus, aunque su comportamiento clínico difiere. El bocavirus se ha identificado como un agente etiológico relevante de infecciones respiratorias agudas, particularmente durante los meses de invierno, afectando tanto a niños como a adultos. Aunque su mecanismo de patogenicidad aún se estudia, su asociación con cuadros respiratorios lo diferencia del parvovirus B19, cuyo tropismo se orienta principalmente al sistema hematopoyético.
Manifestaciones clínicas
El parvovirus B19 es un patógeno humano que presenta un espectro clínico notablemente amplio, con manifestaciones que varían considerablemente según la edad, el estado inmunológico y la presencia de enfermedades subyacentes. Esta variabilidad clínica se explica por el tropismo del virus por las células precursoras eritroides, su capacidad de inducir una respuesta inmunitaria sistémica, y su interacción con el estado fisiológico del huésped. Por ello, el parvovirus B19 puede dar lugar a síndromes distintos en poblaciones diferentes.
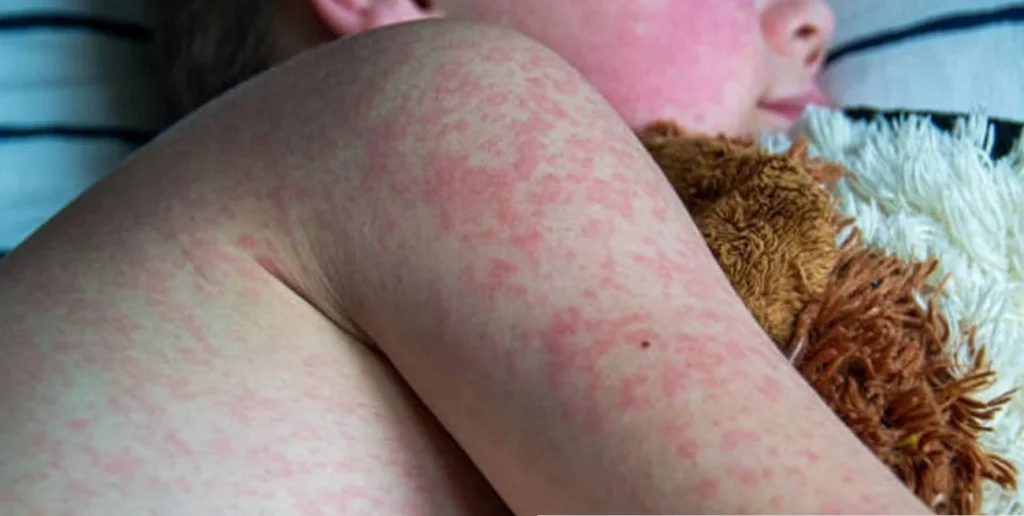
En niños inmunocompetentes, la manifestación más característica es una enfermedad exantemática conocida como eritema infeccioso o “quinta enfermedad”. Este cuadro clínico está marcado por un exantema facial que se presenta como un enrojecimiento intenso y simétrico en ambas mejillas, con palidez circunoral, lo que confiere la apariencia clásica de “mejillas abofeteadas”. Posteriormente, aparece una erupción maculopapular de patrón reticulado o lacelike en el tronco y las extremidades, la cual es transitoria y tiende a desvanecerse espontáneamente. Además del eritema infeccioso clásico, en niños también se ha descrito la aparición de lesiones cutáneas atípicas asociadas a la infección por parvovirus B19, como celulitis eosinofílica (síndrome de Wells), erupciones microvesiculares, y otros exantemas no específicos.
De manera significativa, el parvovirus B19 también se ha identificado como una causa importante de miocarditis en la infancia, una complicación inflamatoria que puede comprometer gravemente la función cardíaca y cuya etiología viral no siempre es fácilmente reconocida. Esta asociación subraya la capacidad del virus para afectar tejidos extracutáneos y provocar una respuesta inmunoinflamatoria sistémica.
En pacientes inmunocomprometidos, como aquellos con inmunodeficiencias primarias o adquiridas, receptores de trasplantes o personas en tratamiento inmunosupresor, la infección por parvovirus B19 adopta una forma mucho más grave y persistente. Una de las manifestaciones más relevantes en este grupo es la aplasia pura de glóbulos rojos, que se presenta como una supresión selectiva de la eritropoyesis. Esta condición puede ser clínicamente silenciosa o manifestarse con anemia severa sin reticulocitosis, lo que refleja una detención casi completa de la producción de eritrocitos. Los aspirados de médula ósea en estos casos muestran una marcada ausencia de precursores eritroides maduros y la presencia de pronormoblastos gigantes con inclusiones virales intranucleares, lo cual es característico de la infección activa.
Además, estudios moleculares han demostrado la presencia del genoma viral del parvovirus B19 en una proporción significativa de pacientes con leucemia aguda y leucemia mieloide crónica, lo que sugiere un posible papel del virus como factor coadyuvante en la patogenia o evolución de estas neoplasias hematológicas. Asimismo, se ha observado una elevada prevalencia de infección por parvovirus B19 en pacientes sometidos a diálisis crónica, probablemente relacionada con la inmunosupresión relativa y la exposición frecuente a productos sanguíneos.
En los adultos, la infección por parvovirus B19 puede dar lugar a un amplio espectro de manifestaciones clínicas, muchas de las cuales difieren notablemente de las observadas en niños. Esta variabilidad se relaciona con la madurez del sistema inmunológico, la presencia de enfermedades subyacentes, y el modo en que el virus interactúa con los tejidos del huésped. En particular, el sistema musculoesquelético, el sistema nervioso central, y el sistema inmunológico pueden verse profundamente afectados.
Una de las presentaciones más características en adultos, especialmente en mujeres de mediana edad, es una poliartritis simétrica no erosiva que clínicamente puede imitar enfermedades autoinmunes como el lupus eritematoso sistémico y la artritis reumatoide. Este cuadro articular, que a menudo afecta pequeñas articulaciones de manos y pies, puede ser transitorio pero debilitante, y se ha asociado, en algunos casos, con crioglobulinemia mixta tipo II, lo cual sugiere una implicación inmunológica sostenida por complejos inmunes circulantes. A diferencia de los niños, los adultos presentan con menor frecuencia exantemas, incluyendo las erupciones faciales típicas, lo que puede dificultar el diagnóstico clínico.
Desde el punto de vista hematológico, se ha observado que fármacos como la cloroquina y sus derivados pueden agravar la anemia asociada a la infección por parvovirus B19. En regiones endémicas de malaria, donde estos fármacos se utilizan con frecuencia, se ha documentado una reducción significativa del hematocrito en pacientes hospitalizados, lo que sugiere una interacción adversa entre la medicación y la patogenia viral. Esta situación puede complicar aún más el manejo de pacientes con enfermedades crónicas como la drepanocitosis, quienes además presentan con frecuencia infecciones subclínicas por el virus.
Aunque menos frecuentes, las manifestaciones extrapulmonares y sistémicas del parvovirus B19 en adultos son numerosas y a menudo graves. Entre ellas se incluyen miocarditis con necrosis isquémica, pericarditis constrictiva, miocardiopatía dilatada crónica, uveítis, encefalitis, meningoencefalitis, y neuropatías periféricas como plexitis braquial y síndrome del túnel carpiano. También se han descrito casos de vasculitis del sistema nervioso central, accidentes cerebrovasculares (especialmente en pacientes con anemia falciforme y crisis aplásicas), y encefalopatías inflamatorias. Además, existen reportes de hepatopatía aguda, hepatitis fulminante, neumonitis, neutropenia, trombocitopenia, glomerulonefritis, y manifestaciones que simulan enfermedades autoinmunes como esclerosis sistémica, síndrome antifosfolípido, y lupus eritematoso sistémico.
Un cuadro dermatológico distintivo asociado al parvovirus B19 es el denominado síndrome papular-purpúrico “de guantes y calcetines”, caracterizado por erupciones simétricas en las manos y los pies, acompañadas de edema, prurito y a veces petequias. En algunos casos, estas manifestaciones cutáneas se han vinculado a hipersensibilidad farmacológica, sugiriendo una interacción entre la infección viral y la respuesta inmunitaria frente a medicamentos.
También se ha descrito una forma específica de artritis postviral denominada sinovitis seronegativa simétrica recurrente con edema, la cual ha sido relacionada serológicamente con infección por parvovirus B19. En individuos con enfermedades hematológicas, como la drepanocitosis, las infecciones pueden permanecer asintomáticas pero aun así desencadenar crisis aplásicas graves.
Durante el embarazo, la infección por parvovirus B19 adquiere un significado clínico especial, ya que el virus puede atravesar la placenta en aproximadamente el 30 % de los casos. Las consecuencias para el feto pueden ser severas e incluyen anemia fetal, hidropesía fetal, parto prematuro e incluso muerte intrauterina. Por ello, ante la sospecha clínica o la exposición documentada, es fundamental realizar estudios serológicos a la persona gestante y brindar un seguimiento estrecho en caso de resultados positivos.
Estudios epidemiológicos y moleculares recientes han ampliado aún más la comprensión de las asociaciones del parvovirus B19. Una encuesta serológica realizada en Francia sugiere una mayor prevalencia de infección entre personas con diagnóstico de esquizofrenia, lo cual ha despertado el interés sobre posibles vínculos neuroinmunológicos. Asimismo, investigaciones mediante metagenómica han señalado una posible implicación de los parvovirus en casos de fibrosis tubulointersticial renal, abriendo una nueva línea de investigación sobre los efectos persistentes de este virus en órganos distintos a la médula ósea.
Exámenes diagnósticos
El diagnóstico de la infección por parvovirus B19 es fundamentalmente clínico, basado en la presentación de signos y síntomas característicos que varían según el grupo etario y el estado inmunológico del paciente. Sin embargo, para confirmar la infección, especialmente en contextos clínicos complejos o atípicos, se requiere la utilización de pruebas de laboratorio específicas, entre las cuales destacan la detección de anticuerpos IgM específicos contra el virus y la amplificación del material genético viral mediante reacción en cadena de la polimerasa.
En pacientes inmunocompetentes, la infección suele manifestarse con signos clínicos definidos, como el exantema típico en niños o la poliartritis simétrica en adultos. En estos casos, al momento en que se presentan los síntomas más comunes, como el rash cutáneo o el compromiso articular, la viremia ya suele haberse resuelto. No obstante, los anticuerpos IgM contra el parvovirus B19 generalmente ya están presentes en suero y pueden ser detectados mediante técnicas serológicas. La presencia de IgM se considera un marcador de infección reciente o activa y tiene alta sensibilidad diagnóstica en pacientes con un sistema inmunológico funcional.
En contraste, en individuos inmunocomprometidos, la producción de anticuerpos puede estar severamente limitada o ausente, lo cual disminuye la utilidad de las pruebas serológicas. En este contexto, la técnica diagnóstica de elección es la detección directa del ADN viral mediante reacción en cadena de la polimerasa con retrotranscripción (RT-PCR), aplicada a muestras de suero o médula ósea. Esta técnica permite identificar la presencia del genoma viral incluso en ausencia de una respuesta inmunitaria humoral, y es especialmente útil en casos de aplasia medular, anemia persistente o infecciones crónicas.
Es importante destacar que, en algunos pacientes, pueden encontrarse autoanticuerpos como los anticuerpos antifosfolípido y los anticuerpos citoplasmáticos antineutrófilos. La presencia de estos autoanticuerpos se ha relacionado con el fenómeno de mimetismo molecular, por el cual determinados epítopos del parvovirus B19 comparten similitud estructural con autoantígenos humanos, lo que puede inducir una respuesta autoinmune transitoria. Esta respuesta inmune cruzada contribuye a la aparición de manifestaciones clínicas que simulan enfermedades autoinmunes, complicando el diagnóstico diferencial.
Además, deben tenerse en cuenta posibles interferencias diagnósticas. Por ejemplo, pacientes que han recibido recientemente inmunoglobulina intravenosa o terapias dirigidas contra linfocitos B pueden presentar serologías falsamente positivas, debido a la presencia de anticuerpos pasivos o a alteraciones en la respuesta inmunitaria. De manera similar, la persistencia de fragmentos virales en tejidos o suero, sin replicación activa del virus, puede ocasionar resultados positivos en PCR, sin que ello indique necesariamente una infección en curso. Estas situaciones subrayan la necesidad de interpretar los resultados de laboratorio en su contexto clínico y de combinar métodos diagnósticos cuando sea necesario.
La evaluación de tejido medular mediante técnicas moleculares se reserva para situaciones en las que ya está indicado realizar una biopsia o aspirado de médula ósea por razones hematológicas específicas, como el estudio de anemia aplásica, pancitopenia inexplicada o sospecha de neoplasia hematológica. En estos casos, la detección de ADN viral en la médula puede confirmar la implicación del parvovirus B19 en la patogenia del cuadro clínico.
Tratamiento
El tratamiento de la infección por parvovirus B19 depende fundamentalmente del estado inmunológico del paciente y de la gravedad de las manifestaciones clínicas. En individuos inmunocompetentes, la infección suele ser autolimitada y benigna, por lo que el manejo es predominantemente sintomático. En este grupo, los antiinflamatorios no esteroideos son comúnmente utilizados para aliviar las artralgias y la poliartritis, especialmente en adultos. Cuando se presenta una crisis aplásica transitoria, situación que puede observarse en pacientes con trastornos hematológicos subyacentes como la anemia falciforme o la esferocitosis hereditaria, puede ser necesario administrar transfusiones de concentrados de glóbulos rojos para corregir la anemia aguda. Estas crisis se caracterizan por una rápida disminución de los niveles de hemoglobina y una reticulocitopenia marcada, que reflejan una interrupción abrupta de la eritropoyesis.
En contraste, los pacientes inmunosuprimidos, incluyendo aquellos con infección por el virus de inmunodeficiencia humana, trasplantados o bajo tratamiento inmunosupresor prolongado, presentan un riesgo significativamente mayor de desarrollar formas crónicas de la infección por parvovirus B19. En estos casos, la incapacidad del sistema inmunitario para generar una respuesta humoral eficaz impide la eliminación del virus, lo que puede dar lugar a una aplasia pura de glóbulos rojos persistente. En este contexto, el tratamiento de elección es la administración de inmunoglobulina intravenosa. Este tratamiento ha demostrado ser altamente eficaz para reducir temporalmente la anemia, al proporcionar anticuerpos neutralizantes que permiten controlar la replicación viral.
Sin embargo, los efectos de la inmunoglobulina intravenosa son transitorios. Es común que los pacientes experimenten recaídas aproximadamente cuatro meses después del tratamiento inicial, una vez que los anticuerpos administrados han sido catabolizados y si el sistema inmunológico del paciente no es capaz de montar una respuesta autónoma. Por esta razón, puede ser necesario administrar ciclos repetidos de inmunoglobulina en pacientes con inmunosupresión crónica o persistente.
Es importante señalar que, a pesar de su utilidad en el tratamiento de la anemia asociada a parvovirus B19, la inmunoglobulina intravenosa no ha demostrado eficacia en la prevención ni en la mitigación de las complicaciones neurológicas, como la encefalitis. Esto sugiere que los mecanismos patogénicos que conducen al daño del sistema nervioso central en la infección por parvovirus B19 podrían no estar mediadas exclusivamente por la replicación viral, sino también por mecanismos inmunitarios o inflamatorios secundarios, lo que limita la utilidad terapéutica de la inmunoglobulina en este contexto.
En el ámbito obstétrico, la infección materna por parvovirus B19 durante el embarazo puede tener consecuencias graves para el feto, en particular la anemia fetal severa, la hidropesía fetal y la muerte intrauterina. En casos seleccionados de anemia fetal significativa, puede considerarse la transfusión sanguínea intrauterina como una medida terapéutica para corregir la anemia y mejorar el pronóstico fetal. No obstante, aunque este procedimiento puede ser vital en algunos casos, también se ha asociado con un riesgo aumentado de alteraciones en el desarrollo neurológico del feto. Este riesgo podría deberse tanto a la propia hipoxia fetal previa a la intervención como a las posibles complicaciones inherentes al procedimiento invasivo, como la hemorragia, la infección o el parto prematuro inducido.
Prevención y pronóstico
La infección por parvovirus B19, aunque generalmente benigna en individuos inmunocompetentes, presenta implicaciones significativas en el ámbito hospitalario y en poblaciones vulnerables. Se han documentado múltiples brotes nosocomiales, lo que pone de manifiesto la capacidad del virus para transmitirse en entornos clínicos cerrados, especialmente en unidades de cuidados intensivos, pediátricas o de hematología. Estos brotes suelen originarse a partir de un individuo infectado, generalmente durante la fase prodrómica o de viremia, y se propagan a través del contacto cercano con secreciones respiratorias, particularmente cuando no se cumplen adecuadamente las medidas de control de infecciones.
En estos contextos, la aplicación rigurosa de guías estándar de contención resulta esencial para prevenir la propagación del virus. Las medidas incluyen el lavado de manos meticuloso después del contacto con pacientes, el uso de barreras físicas cuando se anticipa exposición a fluidos corporales, y, de manera crítica, evitar el contacto entre personal infectado y personas gestantes. La razón de esta última precaución radica en la alta susceptibilidad del feto a la infección, ya que el parvovirus B19 atraviesa la placenta con facilidad. Entre las gestantes infectadas, la aparición de hidropesía fetal constituye un marcador de mal pronóstico. Esta condición, caracterizada por la acumulación anormal de líquido en compartimentos fetales, suele reflejar una anemia fetal severa secundaria a la destrucción de precursores eritroides, y con frecuencia se asocia a muerte fetal intrauterina.
Los datos serológicos muestran que ciertos grupos ocupacionales, como el personal de guarderías infantiles, presentan un riesgo significativamente mayor de adquirir la infección por parvovirus B19. Esto se debe al contacto frecuente y estrecho con niños pequeños, quienes son una de las principales fuentes de diseminación del virus. En estos casos, es imperativo reforzar las prácticas de higiene personal, tales como el lavado de manos frecuente, la desinfección de superficies y la exclusión laboral temporal en caso de síntomas compatibles, especialmente en mujeres embarazadas.
A pesar de su capacidad de transmisión, la transmisión del parvovirus B19 por transfusión de hemoderivados es extraordinariamente rara. Por esta razón, los bancos de sangre, tanto en los Estados Unidos como en otros países, no realizan de forma rutinaria pruebas de detección del parvovirus B19 en unidades donadas. Esta política se basa en varios factores: en primer lugar, la mayoría de los donantes que han estado infectados poseen anticuerpos neutralizantes; en segundo lugar, la gran mayoría de los receptores han tenido contacto previo con el virus y poseen inmunidad; y, finalmente, los niveles de viremia en los donantes infectados suelen ser bajos y se consideran insuficientes para provocar infección en receptores inmunocompetentes. Sin embargo, en pacientes particularmente vulnerables, como aquellos inmunosuprimidos o con enfermedades hematológicas, los especialistas en medicina transfusional recomiendan la realización de pruebas de detección de ADN viral después de la transfusión, con el objetivo de descartar infecciones subclínicas o reactivaciones.
En términos generales, el pronóstico de la infección por parvovirus B19 en individuos con un sistema inmunológico intacto es excelente. La enfermedad suele ser autolimitada, y rara vez deja secuelas. No obstante, en pacientes inmunosuprimidos, como aquellos con infección por el virus de inmunodeficiencia humana o en tratamiento inmunosupresor prolongado, la infección puede adoptar una forma crónica. En estos casos, la anemia persistente puede requerir soporte transfusional repetido a lo largo del tiempo. Afortunadamente, en pacientes con infección por el virus de inmunodeficiencia humana, la instauración de terapia antirretroviral efectiva ha demostrado inducir remisión de la infección por parvovirus B19 en muchos casos, al restaurar la competencia inmunológica necesaria para la eliminación viral. Sin embargo, también se ha descrito la aparición del síndrome inflamatorio de reconstitución inmune, un fenómeno en el cual la recuperación de la función inmunológica desencadena una respuesta inflamatoria exagerada frente a antígenos virales residuales, lo que puede complicar el curso clínico.

Fuente y lecturas recomendadas:
- Goldman, L., & Schafer, A. I. (Eds.). (2020). Goldman-Cecil Medicine (26th ed.). Elsevier.
- Loscalzo, J., Fauci, A. S., Kasper, D. L., Hauser, S. L., Longo, D. L., & Jameson, J. L. (Eds.). (2022). Harrison. Principios de medicina interna (21.ª ed.). McGraw-Hill Education.
- Papadakis, M. A., McPhee, S. J., Rabow, M. W., & McQuaid, K. R. (Eds.). (2024). Diagnóstico clínico y tratamiento 2025. McGraw Hill.
- Rozman, C., & Cardellach López, F. (Eds.). (2024). Medicina interna (20.ª ed.). Elsevier España.
- Alves ADR et al. High prevalence of parvovirus B19 infection in patients with chronic kidney disease under hemodialysis: a multicenter study. Int J Infect Dis. 2020;100:350. [PMID: 32927082]
Originally posted on 30 de mayo de 2025 @ 9:07 PM