Las fiebres hemorrágicas virales comprenden un conjunto diverso de enfermedades infecciosas graves que comparten una serie de características clínicas y patológicas comunes, como fiebre alta, afectación vascular, alteraciones en la coagulación y, en muchos casos, hemorragias internas y externas, que pueden progresar hacia el shock y el fallo multiorgánico. Estas enfermedades son causadas por virus de ARN de cadena simple, pertenecientes a distintas familias: Arenaviridae, Bunyaviridae, Filoviridae, Flaviviridae y Nairoviridae. Aunque estos virus difieren entre sí en términos de estructura, vectores y distribución geográfica, comparten mecanismos patogénicos similares que culminan en una disfunción severa del endotelio vascular y una respuesta inmunitaria exacerbada.
Dentro de la familia Flaviviridae se encuentran algunos de los virus más reconocidos, como los que causan el dengue y la fiebre amarilla. Estos virus, transmitidos principalmente por mosquitos del género Aedes, tienen un ciclo de replicación que involucra células del sistema inmune y endotelial, lo que contribuye al síndrome de extravasación plasmática y a las manifestaciones hemorrágicas observadas en las formas graves de la enfermedad. En particular, el dengue puede evolucionar hacia un síndrome de choque con alto riesgo de mortalidad si no se trata adecuadamente.
La familia Filoviridae agrupa a virus como el del Ébola y el de Marburgo, responsables de algunas de las epidemias más letales registradas en el continente africano. Estos virus se transmiten inicialmente desde un reservorio animal, como los murciélagos frugívoros, y luego de persona a persona por contacto con fluidos corporales contaminados. La infección con filovirus produce necrosis tisular extensa, una activación masiva del sistema inmunológico y una alteración profunda de la homeostasis vascular, lo que lleva a una alta mortalidad en ausencia de intervención médica intensiva.
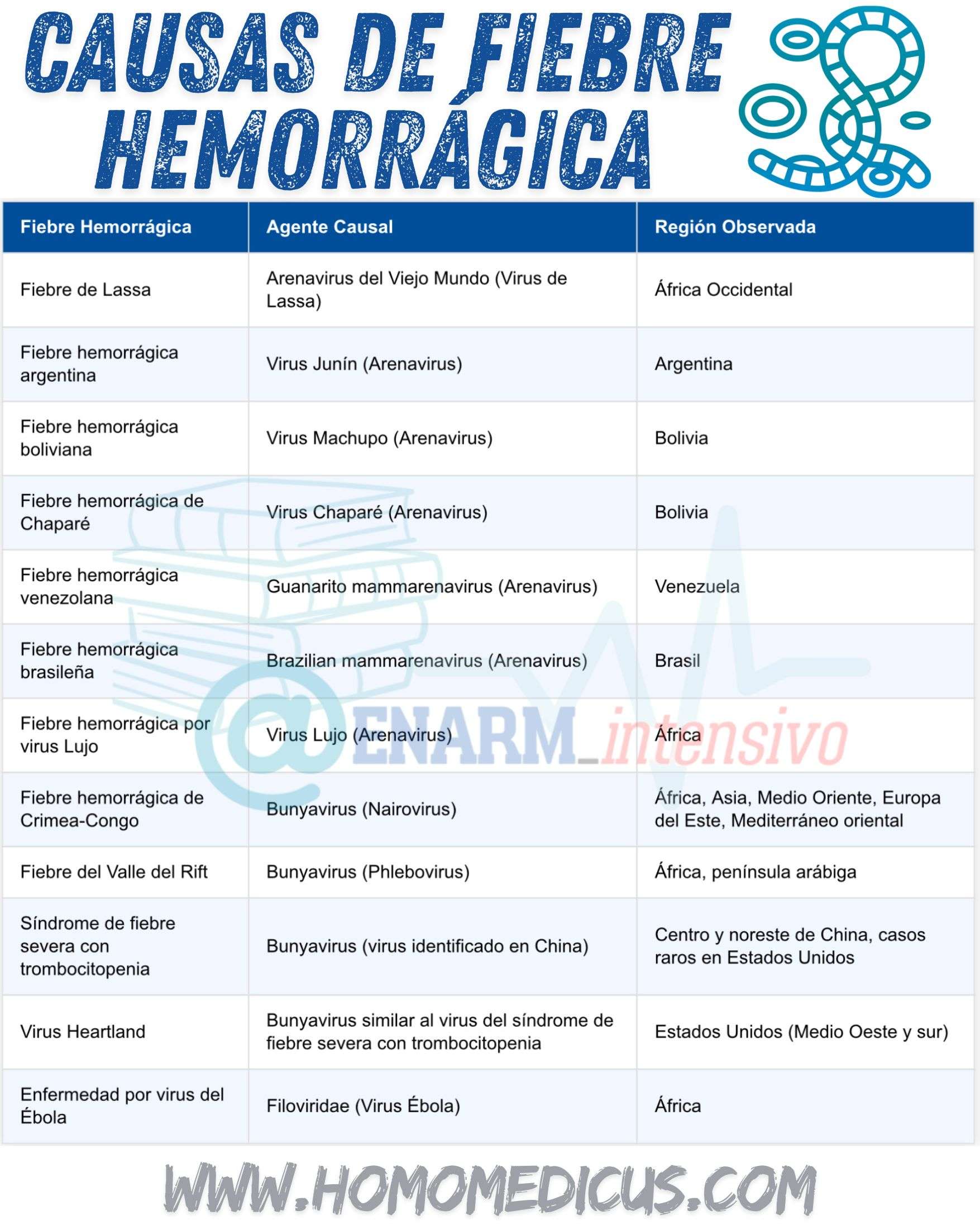
En el caso de la fiebre de Lassa, se trata de una enfermedad endémica en África Occidental provocada por un arenavirus del Viejo Mundo. El principal reservorio del virus es el roedor Mastomys natalensis, que elimina el virus en su orina y heces. Los seres humanos pueden adquirir la infección por contacto directo con estos materiales contaminados, por consumo de alimentos o agua contaminados, o mediante la inhalación de partículas virales suspendidas en el aire. Aunque muchas infecciones son asintomáticas o leves, los casos graves pueden incluir hemorragias, encefalopatía y fallo multiorgánico. Se estima que cada año se producen entre 100,000 y 300,000 casos, con unas 5,000 muertes asociadas. En pacientes hospitalizados con formas graves, las tasas de letalidad pueden llegar hasta el 50 por ciento.
Además del virus de Lassa, existen varios otros arenavirus del Nuevo Mundo que causan fiebres hemorrágicas en América del Sur. Entre ellos se encuentran el virus Junín, causante de la fiebre hemorrágica argentina; el virus Machupo, responsable de la fiebre hemorrágica boliviana; el virus Chaparé, también presente en Bolivia; el Guanarito mammarenavirus, que causa la fiebre hemorrágica venezolana; el Brazilian mammarenavirus, relacionado con la fiebre hemorrágica brasileña; y el virus Lujo. Todos estos virus se transmiten al ser humano principalmente a través del contacto con excreciones de roedores silvestres, y provocan síndromes clínicos que incluyen fiebre alta, hemorragias mucosas, alteraciones neurológicas y en muchos casos desenlaces fatales.
Las fiebres hemorrágicas asociadas a virus de la familia Bunyaviridae también presentan gran importancia en salud pública. Dentro de esta familia destacan los hantavirus, responsables de dos síndromes clínicos principales: la fiebre hemorrágica con síndrome renal y el síndrome pulmonar por hantavirus. Estos virus se transmiten por la inhalación de aerosoles contaminados con excreciones de roedores infectados. Otro miembro relevante de esta familia es el virus de la fiebre hemorrágica de Crimea-Congo, transmitido por garrapatas del género Hyalomma y capaz de causar brotes con elevada mortalidad. La fiebre del Valle del Rift, otra enfermedad bunyaviral, afecta tanto a humanos como a ganado, y es transmitida principalmente por mosquitos. Asimismo, se han identificado virus emergentes como el causante del síndrome de fiebre severa con trombocitopenia, un patógeno recientemente reconocido en Asia que presenta una elevada letalidad.
La fiebre hemorrágica de Crimea-Congo es una enfermedad viral aguda, grave y de rápida evolución, cuya etiología corresponde a un virus perteneciente al género Orthonairovirus, dentro de la familia Nairoviridae. Esta patología zoonótica se transmite principalmente a los seres humanos mediante la picadura de garrapatas del género Hyalomma, las cuales actúan tanto como vectores como reservorios del virus. Además, los animales de ganado doméstico, como vacas, ovejas y cabras, desempeñan un papel crucial como hospedadores amplificadores, ya que pueden albergar altos niveles del virus en sangre sin manifestar signos clínicos de enfermedad. La infección humana puede ocurrir por contacto directo con sangre, tejidos o fluidos corporales de animales infectados, especialmente durante el sacrificio, la asistencia al parto, o el manejo de animales enfermos o recientemente muertos.
Una característica preocupante de la fiebre hemorrágica de Crimea-Congo es su capacidad de transmitirse entre seres humanos. Esta transmisión puede darse en el entorno comunitario o, más frecuentemente, en el contexto hospitalario, mediante el contacto con secreciones corporales contaminadas, como sangre, vómito o fluidos respiratorios. Esta vía de transmisión hace que los trabajadores sanitarios corran un riesgo elevado, especialmente en ausencia de medidas adecuadas de protección biológica y control de infecciones.
La distribución geográfica del virus es notablemente extensa, con casos documentados en amplias zonas de África, Asia, Europa del Este, el Medio Oriente y, de manera destacada, en la región del Mediterráneo oriental. Esta dispersión refleja tanto la amplitud del hábitat de las garrapatas vectores como los patrones de comercio y movilización de animales infectados, lo que facilita la expansión del virus a nuevas regiones ecológicamente susceptibles.
En contraste, la fiebre del Valle del Rift es causada por un virus de la familia Bunyaviridae, perteneciente al género Phlebovirus. Este virus se transmite a los seres humanos principalmente a través de la picadura de mosquitos infectados —particularmente de los géneros Aedes y Culex—, aunque también puede propagarse mediante la exposición directa a fluidos o tejidos de animales infectados, especialmente durante brotes epizoóticos. Las moscas hematófagas también se han implicado como posibles vectores mecánicos.
A diferencia de la fiebre hemorrágica de Crimea-Congo, no se ha documentado transmisión directa entre humanos para la fiebre del Valle del Rift, lo que reduce su potencial de propagación secundaria, aunque no su impacto zoonótico. Entre los factores de riesgo más relevantes para la infección humana se encuentran actividades profesionales o domésticas que implican contacto estrecho con animales infectados: trabajar con tejidos animales abortados, sacrificar o despellejar ganado, o consumir productos animales contaminados, como leche no pasteurizada. La enfermedad se manifiesta típicamente en forma de fiebre, aunque en una pequeña proporción de casos puede progresar a formas más graves, como encefalitis, hemorragias o ceguera.
Geográficamente, esta fiebre se ha asociado históricamente con brotes en el África subsahariana y zonas del Cuerno de África. No obstante, su presencia más reciente en la península arábiga representa una expansión preocupante hacia nuevas regiones, probablemente facilitada por el comercio de ganado infectado o la migración de vectores en condiciones climáticas favorables.
En 2009 se identificó en el centro y noreste de China un nuevo virus dentro del género Phlebovirus, posteriormente denominado virus del síndrome de fiebre severa con trombocitopenia. Este agente emergente también pertenece a la familia Bunyaviridae y presenta un cuadro clínico caracterizado por fiebre alta, trombocitopenia, leucopenia y, en algunos casos, fallo multiorgánico y muerte. El principal vector identificado es la garrapata Haemaphysalis longicornis, un ectoparásito ampliamente distribuido en Asia oriental y, más recientemente, detectado en animales en ciertas regiones del este de los Estados Unidos.
Este virus también puede transmitirse entre humanos por contacto directo con sangre u otros fluidos corporales contaminados, lo cual ha generado preocupación sobre su potencial epidémico, especialmente en áreas con sistemas de salud frágiles o sin protocolos adecuados de control de infecciones.
En Estados Unidos se ha identificado un virus similar, conocido como virus Heartland, también clasificado dentro de los bunyavirus. Su vector principal es la garrapata Amblyomma americanum, comúnmente llamada “Lone Star”, ampliamente distribuida en los estados del Medio Oeste y del sur del país. Aunque los casos humanos documentados hasta la fecha son relativamente pocos, el virus representa un riesgo emergente para la salud pública debido a su capacidad de causar enfermedad febril aguda con trombocitopenia. Los ciervos de cola blanca y los mapaches se consideran posibles reservorios naturales del virus, participando en su mantenimiento y circulación ecológica.
Más recientemente, en el noreste de China se ha identificado un nuevo ortonairovirus denominado virus Songling. Aunque la información sobre este agente aún es limitada, se sabe que causa un síndrome febril agudo, frecuentemente acompañado de cefalea intensa. Se presume que su transmisión también ocurre a través de garrapatas, aunque se requieren más estudios para caracterizar completamente su epidemiología, ciclo zoonótico y potencial de transmisión entre humanos.
Manifestaciones clínicas
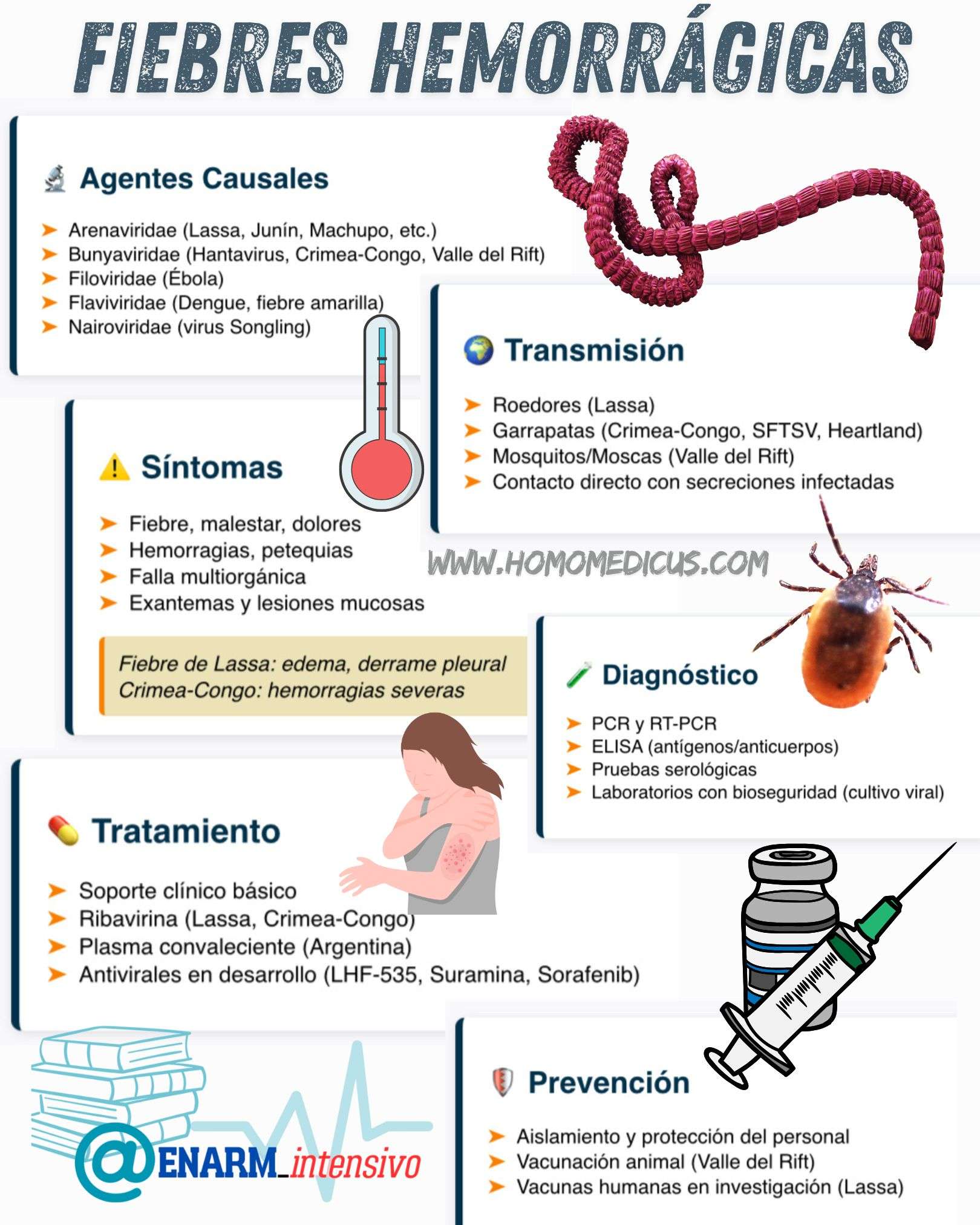
El período de incubación de las fiebres hemorrágicas virales varía considerablemente según la especie viral implicada, así como según la vía de exposición y la carga viral inicial. Este intervalo puede oscilar entre dos y veintiún días, lo que dificulta su identificación precoz, especialmente en entornos donde múltiples enfermedades infecciosas circulan simultáneamente. Durante esta fase de incubación, el virus se replica en el organismo sin causar síntomas evidentes, aunque ya puede estar desencadenando respuestas inmunitarias subclínicas.
La fase inicial o prodrómica de las fiebres hemorrágicas virales se caracteriza por síntomas inespecíficos que dificultan su diferenciación clínica respecto a otras enfermedades virales comunes, como la influenza, el paludismo, o infecciones por enterovirus. Entre estos síntomas se incluyen fiebre alta de inicio súbito, cefalea intensa, mialgias, malestar general, náuseas, vómitos y, en algunos casos, dolor abdominal o articular. Dada esta inespecificidad, resulta fundamental mantener un alto índice de sospecha clínica, especialmente en pacientes pediátricos con fiebre de origen desconocido que residen o han viajado recientemente a regiones endémicas. En estos casos, las fiebres hemorrágicas virales deben figurar de manera prioritaria en el diagnóstico diferencial.
Conforme avanza la infección hacia fases más tardías, el cuadro clínico se vuelve más característico y grave. Los signos clínicos reflejan el compromiso progresivo de múltiples órganos y sistemas. La disfunción orgánica, que puede afectar al hígado, los riñones, los pulmones o el sistema nervioso central, es un hallazgo común. Las alteraciones del estado mental, que incluyen letargo, confusión o coma, pueden indicar encefalopatía viral o hipoxia secundaria. Asimismo, se desarrollan manifestaciones hemorrágicas, como petequias, equimosis, hematemesis, melena, hemorragias nasales o gingivales, y sangrado en sitios de punción venosa. Estas manifestaciones resultan de una combinación de citotoxicidad viral directa, disfunción endotelial, trombocitopenia y coagulopatía.
También pueden observarse exantemas maculopapulares o purpúricos, así como lesiones en las mucosas orales y conjuntivales. Estas lesiones reflejan la fragilidad vascular y el estado inflamatorio sistémico. En algunas infecciones, como la causada por el virus del Ébola, estas manifestaciones hemorrágicas pueden llegar a ser profusas y letales.
En el caso particular de la fiebre de Lassa y de la infección por el virus Lujo, ambos miembros de la familia Arenaviridae, las manifestaciones clínicas avanzadas difieren en parte de las observadas en las infecciones por filovirus. Aunque la fiebre de Lassa puede presentar síntomas hemorrágicos, estos suelen ser menos prominentes que en la enfermedad por virus del Ébola. En cambio, es frecuente la aparición de edema generalizado, derrames pleurales y signos de hipovolemia. Uno de los hallazgos más significativos es la pérdida auditiva, que se presenta en un número considerable de pacientes, incluso en aquellos que sobreviven. Esta hipoacusia puede ser parcial o total, y en muchos casos es irreversible, atribuida probablemente a mecanismos inmunopatológicos. Además, la fiebre de Lassa tiene una alta tasa de mortalidad en mujeres embarazadas, especialmente durante el tercer trimestre, con una elevada frecuencia de pérdida fetal. Esta combinación de factores convierte a la fiebre de Lassa en una amenaza crítica para la salud materno-infantil en regiones endémicas.
En contraste, la fiebre hemorrágica de Crimea-Congo se distingue por una mayor severidad en las manifestaciones hemorrágicas. Los pacientes suelen presentar conjuntivas hiperémicas, congestión facial, enrojecimiento de la faringe, y aparición temprana de petequias en la piel y las mucosas, que con frecuencia progresan a hemorragias más extensas e incontrolables. Este patrón clínico sugiere un daño vascular generalizado y una coagulopatía severa, probablemente impulsada por la liberación masiva de citoquinas proinflamatorias y la activación sistémica del endotelio. El dolor de cabeza intenso, que suele acompañar a esta fase, no solo refleja la fiebre o la inflamación sistémica, sino que también puede estar vinculado a fenómenos de vasodilatación cerebral y presión intracraneal aumentada.
La fiebre del Valle del Rift es una enfermedad viral causada por un Phlebovirus que puede manifestarse clínicamente de formas diversas, dando lugar a tres síndromes clínicos principales, cada uno con características patológicas, pronósticos y complicaciones específicas. La variabilidad en la expresión clínica se relaciona con factores virales, inmunológicos y la interacción huésped-patógeno, que determinan la localización y severidad del daño tisular.
El primer síndrome corresponde a la enfermedad ocular, siendo la retinitis la complicación más frecuente en esta presentación. La retinitis implica inflamación de la retina, la capa neurosensorial del ojo encargada de la percepción visual, lo que conlleva alteraciones en la función visual. Esta inflamación puede provocar daño irreversible en las células retinianas, derivando en pérdida permanente de la visión. Estudios epidemiológicos indican que entre el uno y el diez por ciento de los pacientes afectados desarrollan esta complicación, que puede manifestarse semanas o meses después del cuadro febril agudo inicial. La patogenia de la retinitis en la fiebre del Valle del Rift se atribuye a la invasión directa del virus en las células retinianas, así como a la respuesta inflamatoria local que causa edema, hemorragias y necrosis. Clínicamente, los pacientes pueden presentar visión borrosa, manchas o áreas ciegas, fotofobia y, en casos graves, ceguera irreversible.
El segundo síndrome es la meningoencefalitis, que ocurre en menos del uno por ciento de los casos, caracterizándose por la afectación del sistema nervioso central. En este escenario, el virus invade el tejido cerebral y las meninges, desencadenando inflamación e irritación meníngea y encefálica. Los síntomas característicos incluyen cefalea intensa, fiebre persistente, confusión, alteraciones del nivel de conciencia que pueden progresar a coma, y convulsiones. Estas manifestaciones aparecen generalmente entre una y cuatro semanas después del inicio de la enfermedad febril. A diferencia de la fiebre hemorrágica, la meningoencefalitis tiene una baja tasa de mortalidad, pero la morbilidad es alta debido a los daños neurológicos residuales. Los déficits pueden incluir parálisis, trastornos cognitivos, problemas de memoria y alteraciones motoras, que en muchos casos son permanentes y afectan significativamente la calidad de vida del paciente.
El tercer síndrome corresponde a la fiebre hemorrágica, que se presenta en menos del uno por ciento de los pacientes pero es el más grave en términos de pronóstico. Esta manifestación clínica se caracteriza por un compromiso sistémico severo, con daño hepático grave evidenciado por elevaciones marcadas de enzimas hepáticas y disfunción hepática progresiva. El daño al hígado contribuye a la alteración de la síntesis de factores de coagulación, lo que precipita un estado hemorrágico que se manifiesta clínicamente por hemorragias mucocutáneas, sangrados digestivos, hematuria y hematomas extensos. Los pacientes suelen presentar este cuadro entre dos y cuatro días después del inicio de la enfermedad, con rápida progresión hacia el shock, insuficiencia multiorgánica y fallo hemodinámico. La tasa de letalidad en esta forma clínica es elevada, alcanzando aproximadamente el cincuenta por ciento, reflejando la severidad del compromiso vascular y la dificultad para controlar las complicaciones hemorrágicas y metabólicas.
Estos hallazgos clínicos reflejan el complejo mecanismo fisiopatológico de las fiebres hemorrágicas virales, en el cual el virus desencadena una respuesta inflamatoria excesiva, afecta directamente a las células endoteliales y provoca alteraciones profundas en los sistemas de coagulación y perfusión. La evolución clínica depende tanto del virus involucrado como de factores del huésped, incluyendo la edad, el estado inmunológico y la presencia de comorbilidades. El reconocimiento precoz y el manejo clínico adecuado son fundamentales para mejorar el pronóstico, aunque en muchos casos las opciones terapéuticas son limitadas y se centran principalmente en el soporte intensivo. La identificación oportuna, la implementación de medidas de aislamiento y la vigilancia epidemiológica constituyen pilares esenciales para contener brotes y proteger a la población en riesgo.
Exámenes diagnósticos
Las características hematológicas y bioquímicas observadas en pacientes con fiebres hemorrágicas virales reflejan el impacto sistémico de la infección viral sobre múltiples órganos y sistemas, así como la compleja interacción entre el virus y la respuesta inmunitaria del huésped. Entre los hallazgos más frecuentes se encuentran la trombocitopenia, que consiste en una disminución del recuento de plaquetas en sangre periférica, y que contribuye de manera significativa a la tendencia hemorrágica característica de estas enfermedades. La trombocitopenia puede ser resultado de destrucción plaquetaria directa mediada por el virus, consumo plaquetario secundario a coagulopatías, o secuestro esplénico asociado a la respuesta inflamatoria.
En cuanto a los leucocitos, las alteraciones varían según el virus específico y la fase de la enfermedad. Generalmente, se observa leucopenia, una reducción en el número de leucocitos circulantes, que refleja la supresión medular inducida por la infección viral o la migración de leucocitos hacia tejidos afectados. Sin embargo, en la fiebre de Lassa es común la leucocitosis, aumento del recuento leucocitario, posiblemente debido a la respuesta inflamatoria intensa y la activación inmunológica característica de esta infección.
La anemia es otro hallazgo frecuente y puede ser consecuencia de hemorragias internas, destrucción directa de células sanguíneas, o supresión de la hematopoyesis. Las pruebas bioquímicas hepáticas, como las transaminasas (alanina aminotransferasa y aspartato aminotransferasa), están elevadas, indicando daño hepático directo o secundario a la respuesta inflamatoria sistémica. La disfunción hepática contribuye a la alteración de la síntesis de factores de coagulación, favoreciendo la aparición de coagulopatías.
Un aspecto clínico y de laboratorio crítico es la presencia de alteraciones compatibles con coagulación intravascular diseminada, un trastorno grave caracterizado por la activación sistémica y descontrolada de las vías de coagulación. Esto provoca formación de microtrombos, consumo excesivo de plaquetas y factores de coagulación, y consecuentemente sangrados generalizados, que agravan el cuadro clínico y aumentan la mortalidad.
Debido a la alta infectividad y al riesgo de transmisión, especialmente en el contexto hospitalario y de laboratorio, la manipulación de muestras clínicas procedentes de pacientes sospechosos de fiebres hemorrágicas virales debe realizarse con extremo cuidado. Se requieren medidas estrictas de bioseguridad para proteger al personal y evitar brotes nosocomiales. Es imprescindible que el personal de laboratorio sea informado anticipadamente sobre la sospecha diagnóstica, para implementar protocolos adecuados de contención y uso de equipo de protección personal.
El diagnóstico confirmatorio de estas infecciones se basa en técnicas moleculares y serológicas. La reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) es el método preferido para la detección rápida y sensible del material genético viral en muestras clínicas, lo que permite un diagnóstico precoz y oportuno. Complementariamente, la detección de antígenos virales mediante ensayos inmunoenzimáticos (ELISA) puede ser útil, aunque su sensibilidad y especificidad varían según el momento de la infección y el tipo de muestra.
El diagnóstico serológico, que incluye la demostración de un aumento de cuatro veces en el título de anticuerpos específicos entre muestras pareadas, permite identificar infecciones pasadas o confirmación retrospectiva, aunque su utilidad es limitada en etapas tempranas debido a la demora en la respuesta inmunológica.
El virus de Lassa puede ser aislado en cultivo celular a partir de sangre, orina o hisopados faríngeos, procedimiento que permite la caracterización viral y estudios epidemiológicos. Sin embargo, debido a su alta infectividad y potencial de causar enfermedad grave, el aislamiento requiere laboratorios equipados con niveles altos de bioseguridad (nivel tres o cuatro), con estrictos controles para evitar exposiciones accidentales.
En el caso de la fiebre hemorrágica de Crimea-Congo, la RT-PCR también constituye la herramienta diagnóstica más eficaz, permitiendo detectar rápidamente la presencia viral. Los ensayos ELISA para antígenos y anticuerpos complementan el diagnóstico, aunque las pruebas serológicas pueden generar resultados falsos negativos durante las fases iniciales, cuando la respuesta inmune aún no es detectable, y falsos positivos en etapas tardías, debido a la persistencia de anticuerpos o reacciones cruzadas. Por esta razón, la interpretación de los resultados debe hacerse en el contexto clínico y epidemiológico del paciente.
Diagnóstico diferencial
El diagnóstico diferencial de las fiebres hemorrágicas virales resulta fundamental debido a la presentación clínica inespecífica que estas enfermedades comparten con múltiples patologías infecciosas que también cursan con fiebre, compromiso sistémico y, en ocasiones, manifestaciones hemorrágicas. La precisión diagnóstica es esencial para orientar el manejo clínico adecuado y establecer medidas de control epidemiológico que permitan contener brotes y reducir la morbilidad y mortalidad asociadas.
Entre las enfermedades que deben considerarse en el diagnóstico diferencial de las fiebres hemorrágicas se encuentran la meningococemia y otras septicemias bacterianas graves. Estas infecciones pueden cursar con fiebre alta, petequias, púrpura y compromiso hemodinámico, lo que puede mimetizar el cuadro clínico de las fiebres hemorrágicas virales. La rápida progresión hacia el choque séptico y la respuesta inflamatoria sistémica hacen imprescindible distinguir estas condiciones mediante cultivos, hemocultivos y pruebas específicas que identifiquen el agente causal bacteriano.
Las infecciones por rickettsias, especialmente las causantes de fiebre maculosa o tifus, también comparten síntomas comunes como fiebre, exantema y cefalea intensa, con ocasionales manifestaciones hemorrágicas. La identificación temprana de estas infecciones mediante serología o técnicas moleculares es crucial, dado que el tratamiento antibiótico oportuno puede modificar significativamente el curso de la enfermedad.
El dengue, otro arbovirus prevalente en regiones tropicales y subtropicales, puede presentar un cuadro clínico con fiebre, dolor retroocular, rash y, en formas graves, hemorragias y shock. La similitud en la fase crítica con las fiebres hemorrágicas virales complica el diagnóstico clínico inicial, por lo que las pruebas serológicas y moleculares específicas resultan indispensables para su diferenciación.
La fiebre tifoidea, causada por Salmonella Typhi, puede también confundirse con fiebres hemorrágicas en su presentación inicial, dada la fiebre prolongada, malestar general y afectación sistémica. Aunque no es característicamente hemorrágica, puede asociarse con complicaciones gastrointestinales que incluyen hemorragias, requiriendo de cultivos y pruebas serológicas para su diagnóstico certero.
La malaria, especialmente en sus formas severas, puede manifestarse con fiebre elevada, anemia, alteraciones neurológicas y hemólisis, superponiéndose clínicamente con algunos cuadros virales hemorrágicos. El diagnóstico mediante frotis sanguíneo o técnicas rápidas de detección antigénica es clave para iniciar el tratamiento antiparasitario adecuado.
En el caso particular del síndrome de fiebre severa con trombocitopenia, que se caracteriza por fiebre alta acompañada de reducción marcada de plaquetas, el diagnóstico diferencial debe incluir enfermedades como la anaplasmosis, una infección bacteriana transmitida por garrapatas que afecta los leucocitos y puede presentar síntomas similares. También se deben considerar enfermedades como el síndrome urémico hemolítico o la fiebre hemorrágica con síndrome renal, así como la leptospirosis, una infección bacteriana que puede manifestarse con fiebre, ictericia, insuficiencia renal y hemorragias, requiriendo pruebas serológicas y moleculares específicas para su diferenciación.
Es importante destacar que, aunque estas enfermedades pueden generar cuadros clínicos semejantes, la probabilidad de que los viajeros contraigan fiebres hemorrágicas virales es baja, debido a la distribución geográfica restringida de estos virus, la necesidad de vectores o reservorios específicos, y las condiciones epidemiológicas particulares. Sin embargo, la movilidad humana globalizada y la expansión de vectores pueden modificar este riesgo, por lo que la vigilancia y el conocimiento clínico actualizado son esenciales para la detección oportuna en contextos no endémicos.
Tratamiento
El manejo clínico de pacientes con fiebres hemorrágicas virales requiere estrictas medidas de aislamiento para prevenir la transmisión nosocomial y proteger al personal sanitario, así como a otros pacientes. Por esta razón, los pacientes deben ser alojados en habitaciones individuales que permitan el control efectivo de las fuentes de contagio. Las precauciones estándar incluyen barreras para el contacto directo con fluidos corporales y superficies contaminadas, además de medidas para evitar la dispersión de gotículas respiratorias, las cuales constituyen una vía común de transmisión en estos virus.
El personal de salud debe implementar precauciones de barrera rigurosas, empleando equipo de protección personal adecuado, que incluye guantes, batas impermeables, protección ocular y respiratoria, para prevenir la contaminación de la piel y las mucosas, áreas vulnerables que facilitan la entrada viral. Estas medidas son especialmente críticas durante la manipulación de muestras biológicas, procedimientos invasivos o cualquier intervención que pueda generar aerosoles. En pacientes con compromiso pulmonar importante o aquellos sometidos a procedimientos que estimulen la tos, tales como intubación endotraqueal, broncoscopias o aspiraciones, se deben adoptar precauciones adicionales contra la transmisión aérea. Esto incluye el uso de respiradores N95 o equivalentes y la realización de estos procedimientos en ambientes con presión negativa, con el fin de evitar la dispersión viral en el ambiente.
En cuanto al tratamiento, el pilar fundamental es la terapia de soporte, que abarca el mantenimiento del equilibrio hidroelectrolítico, la corrección de alteraciones hemodinámicas, el soporte respiratorio, el manejo del dolor y la prevención de complicaciones secundarias, tales como infecciones bacterianas. No existe un medicamento antiviral aprobado específicamente para el virus de Lassa; sin embargo, la ribavirina, un nucleósido análogo con actividad antiviral de amplio espectro, ha demostrado reducir la mortalidad cuando se administra en las fases iniciales de la enfermedad. Su eficacia depende de la precocidad en el inicio del tratamiento y la dosificación adecuada.
En el ámbito de la investigación farmacológica, un antiviral de molécula pequeña denominado LHF-535 está en desarrollo para el tratamiento de la fiebre de Lassa y otros arenavirus, mostrando prometedores resultados preclínicos que podrían ampliar las opciones terapéuticas futuras.
Para la fiebre hemorrágica argentina, causada por el virus Junín, el uso de plasma convaleciente se ha establecido como una terapia rutinaria, proporcionando anticuerpos específicos que ayudan a neutralizar el virus y mejorar la respuesta inmune del paciente, disminuyendo así la gravedad y mortalidad de la enfermedad.
La profilaxis posexposición con ribavirina ha mostrado eficacia en el manejo de la fiebre hemorrágica de Crimea-Congo, aunque la evidencia para su uso en fiebre de Lassa y otros arenavirus es limitada, lo que indica la necesidad de estudios adicionales para confirmar su utilidad y definir protocolos claros.
En relación con la fiebre del Valle del Rift, el agente antitripanosómico suramina ha sido evaluado por su posible efecto antiviral, aunque la evidencia clínica es aún preliminar. Asimismo, el sorafenib, un inhibidor de tirosina quinasa aprobado para el tratamiento de ciertos carcinomas, ha exhibido actividad antiviral contra el virus de la fiebre del Valle del Rift en estudios experimentales, abriendo nuevas perspectivas terapéuticas.
En materia preventiva, se han desarrollado vacunas humanas para la fiebre del Valle del Rift, así como varias vacunas experimentales para el virus de Lassa, aunque estas últimas permanecen en fases de investigación y no están disponibles para uso generalizado. La prevención de la fiebre del Valle del Rift se basa primordialmente en la vacunación del ganado susceptible, principal reservorio y fuente de transmisión durante los brotes epidémicos. Existen diversas vacunas desarrolladas para uso veterinario, entre las cuales la vacuna Smithburn, un virus vivo atenuado, es la única que se produce comercialmente y se emplea en África Oriental, mostrando eficacia para reducir la incidencia y severidad de la enfermedad en animales, lo que indirectamente disminuye el riesgo de transmisión a humanos.
En síntesis, el manejo clínico y la prevención de las fiebres hemorrágicas virales requieren un abordaje multifactorial que incluye aislamiento estricto, terapias antivirales en desarrollo, tratamientos con plasma convaleciente y estrategias de vacunación dirigidas tanto a humanos como a animales, con el objetivo de minimizar la morbilidad, mortalidad y el impacto epidemiológico de estas enfermedades emergentes.

Fuente y lecturas recomendadas:
- Goldman, L., & Schafer, A. I. (Eds.). (2020). Goldman-Cecil Medicine (26th ed.). Elsevier.
- Loscalzo, J., Fauci, A. S., Kasper, D. L., Hauser, S. L., Longo, D. L., & Jameson, J. L. (Eds.). (2022). Harrison. Principios de medicina interna (21.ª ed.). McGraw-Hill Education.
- Papadakis, M. A., McPhee, S. J., Rabow, M. W., & McQuaid, K. R. (Eds.). (2024). Diagnóstico clínico y tratamiento 2025. McGraw Hill.
- Rozman, C., & Cardellach López, F. (Eds.). (2024). Medicina interna (20.ª ed.). Elsevier España.
Originally posted on 26 de mayo de 2025 @ 7:45 AM