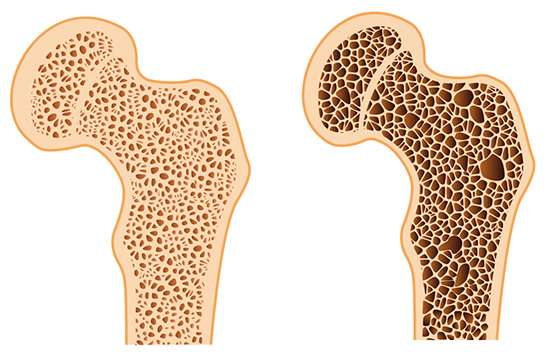
La osteoporosis es una enfermedad caracterizada por la pérdida de la matriz ósea, también conocida como osteoide, lo que resulta en una disminución de la integridad y la resistencia del hueso. Este proceso lleva a un debilitamiento de la estructura ósea, lo que aumenta la predisposición a sufrir fracturas por fragilidad. La fragilidad ósea se refiere a una disminución en la capacidad del hueso para resistir fuerzas que normalmente no causarían daño en huesos saludables. A medida que los huesos se debilitan, el riesgo de fractura se incrementa significativamente. En las mujeres blancas mayores de 50 años, especialmente aquellas que no reciben reemplazo de estrógenos, se estima que tienen un 46% de riesgo de sufrir una fractura osteoporótica durante el resto de sus vidas, lo que subraya la gravedad de la enfermedad en este grupo demográfico.
Una de las fracturas más comunes asociadas con la osteoporosis es la fractura vertebral. Estas fracturas suelen diagnosticarse de forma incidental mediante radiografías o tomografías computarizadas (TC), ya que pueden no presentar síntomas evidentes en las primeras etapas. Las fracturas vertebrales ocurren cuando las vértebras, que forman la columna vertebral, se debilitan debido a la pérdida de masa ósea, lo que puede resultar en la deformación de la columna, dolor crónico y una disminución significativa de la calidad de vida.
En los últimos años, el riesgo de fracturas de cadera ha disminuido, en parte gracias a la reducción del tabaquismo, lo que ha influido positivamente en la salud ósea de la población en general. Sin embargo, a pesar de esta disminución, el riesgo de fracturas por fragilidad sigue siendo elevado, y varía en función de la etnia, el sexo y la edad. El riesgo de fractura de cadera durante toda la vida es del 12.1% en las mujeres blancas, frente al 4.6% en los hombres blancos. Este riesgo es menor en las mujeres y hombres latinos, y aún más bajo en las mujeres y hombres asiáticos, con diferencias de sexo similares. Los adultos negros también presentan un riesgo más bajo de fractura en comparación con otras poblaciones. Por otro lado, la variabilidad étnica en las fracturas vertebrales es mucho menos pronunciada. En mujeres mayores de 65 años, la prevalencia de fracturas vertebrales es del 70% en las mujeres blancas, del 68% en las mujeres japonesas, del 55% en las mujeres mexicanas y del 50% en las mujeres negras. Estos datos destacan las diferencias en la prevalencia de fracturas vertebrales entre diferentes grupos étnicos, aunque las tasas siguen siendo notablemente altas en todas las poblaciones.
La osteoporosis puede ser causada por una variedad de factores, entre los cuales el envejecimiento es uno de los más comunes. Con el paso de los años, la densidad ósea disminuye de manera natural, lo que aumenta la vulnerabilidad de los huesos. Además, la deficiencia de hormonas sexuales, especialmente en las mujeres después de la menopausia, contribuye significativamente al desarrollo de la enfermedad. La disminución en los niveles de estrógeno en las mujeres provoca una acelerada pérdida de masa ósea, lo que aumenta el riesgo de osteoporosis.
Otros factores de riesgo importantes incluyen el consumo excesivo de alcohol, el tabaquismo, el uso prolongado de inhibidores de la bomba de protones (PPI, por sus siglas en inglés) y la administración de corticosteroides en dosis altas. El uso prolongado de PPI, que se emplean para tratar afecciones gástricas como el reflujo gastroesofágico, ha sido vinculado a una mayor pérdida de masa ósea, especialmente cuando se usan a largo plazo. Por otro lado, los corticosteroides son medicamentos antiinflamatorios potentes que, aunque útiles en el tratamiento de diversas afecciones, pueden debilitar los huesos cuando se administran de forma crónica.
En cuanto a la población masculina, los hombres que padecen hipogonadismo (una condición en la que el cuerpo produce niveles bajos de testosterona) o aquellos que reciben terapia antiandrogénica para tratar el cáncer de próstata también están en riesgo de desarrollar osteoporosis. Este grupo debe ser monitoreado regularmente con técnicas de densitometría ósea, que permiten evaluar la densidad mineral ósea y detectar signos tempranos de osteoporosis.
El consumo prolongado de bebidas cola también ha demostrado estar asociado con un mayor riesgo de osteoporosis en mujeres, particularmente en la cadera. Este riesgo se atribuye en parte al alto contenido de fosfatos en las bebidas cola, los cuales pueden interferir con la absorción de calcio, un mineral esencial para la salud ósea.
Causas
La osteoporosis es una enfermedad compleja que puede ser causada por una variedad de factores, tanto intrínsecos como extrínsecos, que afectan la salud ósea. Estos factores incluyen el envejecimiento, el consumo de sustancias, predisposiciones genéticas, deficiencias hormonales, trastornos metabólicos y enfermedades crónicas, entre otros.
Envejecimiento: El envejecimiento es uno de los principales factores de riesgo para la osteoporosis. A medida que las personas envejecen, hay una disminución en la capacidad del cuerpo para formar hueso nuevo, mientras que la resorción ósea, es decir, la destrucción del hueso viejo, continúa a un ritmo elevado. Esto resulta en una pérdida neta de masa ósea y una mayor fragilidad del esqueleto. En las mujeres, este proceso se ve acentuado por la disminución de los niveles de estrógeno después de la menopausia, lo que acelera la pérdida ósea.
Uso excesivo de alcohol (alcoholismo): El consumo crónico de alcohol puede interferir con la capacidad del cuerpo para formar huesos saludables. El alcohol afecta negativamente el metabolismo del calcio, la vitamina D y otros nutrientes esenciales para la salud ósea. Además, el alcohol puede alterar la función de las células óseas responsables de la formación de hueso, lo que acelera la pérdida de densidad ósea.
Tabaquismo: Fumar cigarrillos es otro factor de riesgo conocido para la osteoporosis. El tabaquismo reduce la circulación sanguínea en los huesos, lo que limita el suministro de nutrientes esenciales para la formación y mantenimiento del hueso. Además, el humo del cigarro tiene efectos negativos sobre las hormonas que regulan el equilibrio óseo, especialmente en las mujeres postmenopáusicas.
Consumo de cola en mujeres (fracturas de cadera): El consumo excesivo de bebidas cola ha sido asociado con un mayor riesgo de osteoporosis, particularmente en las mujeres. Esto se debe al alto contenido de ácido fosfórico en las bebidas cola, que puede interferir con la absorción de calcio, un mineral crucial para la salud ósea. Las mujeres que consumen estas bebidas durante períodos prolongados pueden estar en un mayor riesgo de sufrir fracturas, especialmente en la cadera.
Etnicidad y sexo: La etnicidad juega un papel importante en la prevalencia de la osteoporosis. Las mujeres blancas tienen un riesgo más alto de desarrollar osteoporosis en comparación con otros grupos étnicos, aunque las mujeres asiáticas y latinas también tienen una prevalencia significativa. Además, el sexo es un factor determinante, ya que las mujeres son más propensas a desarrollar osteoporosis que los hombres debido a los efectos hormonales de la menopausia.
Trastornos genéticos: Existen varios trastornos genéticos que predisponen al desarrollo de osteoporosis. Algunos de los más conocidos incluyen:
-
Deficiencia de aromatasa: Esta condición impide la conversión adecuada de los andrógenos a estrógenos, lo que puede llevar a una deficiencia hormonal en mujeres y aumentar el riesgo de osteoporosis.
-
Trastornos del colágeno (síndrome de Ehlers-Danlos): Las personas con defectos en el colágeno, como en el síndrome de Ehlers-Danlos, tienen una mayor fragilidad ósea debido a la debilidad estructural de los huesos, lo que aumenta el riesgo de fracturas.
-
Homocistinuria: Este trastorno metabólico se asocia con un mayor riesgo de osteoporosis debido a la acumulación de homocisteína, un aminoácido que daña el colágeno y otros tejidos conectivos.
-
Hipofosfatasia: Una enfermedad rara en la que la deficiencia de fosfatasa alcalina impide la mineralización ósea adecuada, lo que puede causar fracturas y deformidades óseas.
-
Osteoporosis juvenil idiopática: La forma idiopática de la osteoporosis que afecta a los niños y jóvenes sin una causa aparente, que a menudo se asocia con fracturas frecuentes y pérdida de masa ósea.
-
Síndrome de Marfan y osteogénesis imperfecta: Ambos trastornos genéticos afectan la estructura del tejido conectivo y el colágeno, lo que aumenta la fragilidad ósea.
Deficiencia hormonal: La deficiencia de hormonas sexuales juega un papel crucial en el desarrollo de la osteoporosis. En las mujeres, la disminución de los niveles de estrógeno tras la menopausia aumenta la resorción ósea y reduce la formación de hueso. En los hombres, la baja de testosterona también está relacionada con la pérdida ósea, aunque este proceso es más gradual en comparación con las mujeres.
Exceso hormonal: El exceso de algunas hormonas también puede contribuir a la osteoporosis. Por ejemplo, el síndrome de Cushing, que se caracteriza por un exceso de cortisol, y la hiperparatiroidismo, en la que hay un exceso de la hormona paratiroidea, pueden aumentar la resorción ósea y reducir la densidad ósea.
Baja actividad física e inmovilización: La falta de actividad física regular, especialmente ejercicios de carga como caminar, correr o levantar pesas, contribuye a la pérdida de masa ósea. La inmovilización prolongada también puede acelerar la pérdida ósea, ya que los huesos necesitan estímulos mecánicos para mantenerse fuertes.
Enfermedades malignas: Algunos tipos de cáncer, en particular el mieloma múltiple (un cáncer de las células plasmáticas), pueden afectar la salud ósea. El mieloma produce proteínas que destruyen el hueso, lo que lleva a fracturas y debilidad ósea.
Medicamentos: Varios medicamentos de uso prolongado están asociados con un mayor riesgo de osteoporosis. Entre estos se encuentran:
-
Inhibidores de aromatasa: Usados en el tratamiento del cáncer de mama, estos medicamentos reducen los niveles de estrógeno y aumentan el riesgo de pérdida ósea.
-
Corticosteroides: El uso crónico de corticosteroides reduce la formación ósea y aumenta la resorción, lo que lleva a la osteoporosis.
-
Inhibidores de GnRH: Utilizados en el tratamiento de trastornos como el cáncer de próstata, estos inhibidores reducen los niveles de testosterona y afectan la salud ósea.
-
Heparina: Un anticoagulante que, cuando se usa a largo plazo, puede inducir pérdida ósea.
-
Pioglitazona y PPI (inhibidores de la bomba de protones): Ambos están relacionados con un aumento en el riesgo de fracturas debido a sus efectos sobre el metabolismo óseo.
Condiciones generales: Varias condiciones médicas pueden contribuir al desarrollo de la osteoporosis, como:
-
Anorexia nerviosa: La restricción calórica y la malnutrición en esta enfermedad pueden debilitar los huesos.
-
Enfermedad celíaca y fibrosis quística: Ambas son enfermedades que afectan la absorción de nutrientes esenciales, como el calcio y la vitamina D, lo que conduce a una mayor fragilidad ósea.
-
Diabetes mellitus no controlada y VIH: Estas enfermedades pueden alterar el metabolismo óseo y aumentar el riesgo de fracturas.
-
Hiponatremia crónica y enfermedades hepáticas crónicas: Ambas condiciones pueden afectar negativamente la salud ósea debido a desequilibrios en los electrolitos y el metabolismo general.
-
Artritis reumatoide y malnutrición proteico-calórica: Estas enfermedades autoinmunes y trastornos nutricionales también están asociadas con un mayor riesgo de osteoporosis.
Manifestaciones clínicas
La osteoporosis es una enfermedad metabólica ósea caracterizada por una disminución progresiva de la densidad y la calidad del hueso, lo que resulta en una mayor fragilidad ósea y una predisposición aumentada a las fracturas. Sin embargo, la osteoporosis es frecuentemente asintomática en sus primeras etapas, lo que significa que las personas afectadas pueden no presentar síntomas evidentes hasta que ocurre una fractura. Este retraso en la manifestación clínica de la enfermedad plantea desafíos significativos en su diagnóstico temprano y en la implementación de medidas preventivas.
Las fracturas relacionadas con la osteoporosis suelen ser el primer signo clínico de la enfermedad, y pueden manifestarse de diferentes maneras, dependiendo de la localización y la gravedad de la fractura. Una de las formas más comunes en que la osteoporosis se hace evidente es a través de fracturas vertebrales. Estas fracturas ocurren cuando una o más vértebras de la columna vertebral se comprimen o colapsan debido a la fragilidad del hueso, lo que puede desencadenar dolor en la espalda de intensidad variable. El dolor de espalda puede ir desde una molestia leve hasta un dolor severo y debilitante, que puede afectar significativamente la capacidad del individuo para realizar actividades cotidianas.
En algunos casos, las fracturas vertebrales pueden ocurrir de manera espontánea, es decir, sin un traumatismo evidente o una causa externa. Este tipo de fractura puede ser el resultado de un simple esfuerzo, como levantar un objeto ligero o una tos intensa, que de otro modo no habría causado daño a un hueso saludable. Cuando una vértebra se colapsa, puede haber una alteración significativa en la alineación de la columna vertebral, lo que conduce a la deformidad conocida como cifosis espinal o «joroba». La cifosis es una curvatura anormal hacia adelante de la columna, lo que puede afectar la postura y causar dolor crónico.
Otro síntoma común asociado con la osteoporosis es la pérdida de estatura, que generalmente es el resultado de múltiples fracturas vertebrales pequeñas o subclínicas, que a menudo pasan desapercibidas hasta que se acumulan y producen una deformidad estructural en la columna vertebral. La pérdida de altura es un indicador temprano de que se pueden estar produciendo cambios en la columna debido a la fragilidad ósea, y es una señal de alerta para los médicos en la evaluación de la salud ósea de un paciente.
Las fracturas vertebrales y de cadera son las más prevalentes en los individuos con osteoporosis, y ambas tienen un impacto significativo en la salud y la calidad de vida. Las fracturas vertebrales no solo causan dolor físico, sino que también pueden afectar la función pulmonar y aumentar el riesgo de otras complicaciones. Además, las fracturas de cadera son especialmente preocupantes debido a su alta tasa de mortalidad asociada, particularmente en personas mayores. Estas fracturas suelen requerir intervención quirúrgica, y la recuperación puede ser prolongada, con un riesgo elevado de complicaciones, como infecciones, trombosis venosa profunda y problemas relacionados con la movilidad.
El dolor crónico es una consecuencia común de las fracturas vertebrales y de cadera, lo que puede limitar la capacidad de los pacientes para llevar una vida independiente. El dolor persistente y la incapacidad para realizar actividades cotidianas afectan negativamente la calidad de vida, reduciendo la autonomía y contribuyendo a un círculo vicioso de inmovilización y deterioro de la salud general. Además, el dolor constante puede afectar el estado de ánimo de los pacientes, llevando a la depresión y la ansiedad, que son comunes en aquellos con osteoporosis avanzada.
En cuanto a la evaluación clínica de la osteoporosis, una vez que se diagnostica la enfermedad, es fundamental realizar una historia clínica detallada y un examen físico dirigido para determinar las posibles causas subyacentes de la pérdida ósea. La historia clínica debe incluir preguntas sobre factores de riesgo, como antecedentes familiares de osteoporosis, dieta, consumo de alcohol y tabaco, nivel de actividad física, y cualquier condición médica preexistente que pueda contribuir a la osteoporosis, como trastornos endocrinos o el uso prolongado de medicamentos que afectan la salud ósea, como los corticosteroides.
El examen físico debe centrarse en la evaluación de la postura, la movilidad y la presencia de deformidades, como la cifosis espinal, que son indicativos de fracturas vertebrales. La palpación de la columna vertebral puede revelar puntos sensibles o dolorosos, especialmente en áreas donde se han producido fracturas vertebrales. Además, es importante evaluar la fuerza muscular, la flexibilidad y la capacidad funcional general del paciente, para determinar el grado de afectación y el impacto que la osteoporosis tiene en la vida diaria del individuo.
Es necesario considerar además la realización de pruebas complementarias, como radiografías, tomografías computarizadas o resonancias magnéticas, para confirmar el diagnóstico de fracturas y evaluar el grado de pérdida ósea. Además, la densitometría ósea es una herramienta diagnóstica clave que permite medir la densidad mineral ósea y valorar el riesgo de futuras fracturas. A través de estas pruebas, los médicos pueden clasificar la severidad de la osteoporosis y decidir el tratamiento más adecuado.
Exámenes diagnósticos
El diagnóstico de osteoporosis generalmente se basa en la evaluación de la densidad ósea, pero es fundamental llevar a cabo pruebas de laboratorio para detectar causas secundarias de la enfermedad o condiciones concomitantes, como la osteomalacia, que pueden complicar el manejo de la osteoporosis. La osteoporosis primaria, que es la más común, se desarrolla por factores relacionados con el envejecimiento y las alteraciones hormonales, pero en algunos casos, puede estar asociada con trastornos subyacentes que alteran el metabolismo óseo. Por esta razón, realizar un examen de laboratorio completo es esencial para identificar posibles causas secundarias y para establecer un plan de tratamiento adecuado.
Para los pacientes que presentan una densitometría ósea baja, es necesario realizar un conjunto de análisis de sangre que permita evaluar el estado general de la salud ósea y detectar cualquier anomalía metabólica. Las pruebas iniciales suelen incluir determinaciones de varios parámetros séricos, entre ellos:
-
BUN (nitrógeno ureico sanguíneo) y creatinina: Estos marcadores son esenciales para evaluar la función renal. Dado que los riñones juegan un papel crucial en la regulación del calcio y el fosfato, así como en la activación de la vitamina D, los trastornos renales pueden contribuir a la osteopatía. La insuficiencia renal crónica, por ejemplo, puede provocar un desequilibrio en los electrolitos y una alteración en la síntesis de vitamina D activa, lo que a su vez puede llevar a la pérdida ósea.
-
Albúmina sérica: La albúmina es una proteína plasmática cuya medición es útil para evaluar el estado nutricional general del paciente. Los niveles bajos de albúmina pueden estar asociados con desnutrición, lo que a su vez puede afectar negativamente la salud ósea, ya que los nutrientes esenciales para la formación de hueso pueden estar en niveles inadecuados.
-
Calcio sérico: La medición del calcio es importante, ya que el desequilibrio en los niveles de calcio puede ser un indicio de un trastorno metabólico que afecta al hueso. Un nivel bajo de calcio puede sugerir problemas con la absorción del mineral, deficiencia de vitamina D o disfunción en las glándulas paratiroides.
-
Fosfato sérico y fosfatasa alcalina: El fosfato es un componente clave en la mineralización ósea, y su medición es crucial para determinar si existe algún trastorno en la regulación del metabolismo mineral. La fosfatasa alcalina es una enzima que se encuentra en los huesos, el hígado y otras áreas, y sus niveles pueden estar elevados en condiciones de formación ósea acelerada o alterada. En cambio, niveles bajos de fosfatasa alcalina (por debajo de 40 U/L en adultos) pueden ser indicativos de hipofosfatasia, una enfermedad rara que impide la mineralización ósea adecuada, lo que puede llevar a fracturas y deformidades.
-
Vitamina D (25-hidroxivitamina D o 25HD): La medición de los niveles de 25-hidroxivitamina D es clave para evaluar el estado de vitamina D en el organismo, ya que esta vitamina es esencial para la absorción del calcio en el intestino y para la mineralización ósea. Niveles de 25HD inferiores a 20 ng/mL (50 nmol/L) se consideran indicativos de deficiencia franca de vitamina D, lo que aumenta considerablemente el riesgo de fracturas. Incluso niveles subóptimos de vitamina D pueden predisponer al riesgo de fracturas de cadera, por lo que la insuficiencia de esta vitamina es una preocupación importante en los pacientes con osteoporosis.
Si los niveles de calcio sérico son anormales, se debe realizar una prueba adicional de hormona paratiroidea (PTH). La PTH regula los niveles de calcio en la sangre, y niveles elevados de PTH pueden ser indicativos de hiperparatiroidismo, una condición que puede causar pérdida ósea debido al aumento de la resorción ósea. La medición de esta hormona es crucial para identificar posibles causas secundarias de la osteoporosis.
Hemograma completo (CBC): Un hemograma completo debe ser realizado para evaluar el estado general de la salud del paciente, y en particular para identificar signos de anemia. En caso de que se detecte anemia, se debe realizar una investigación adicional, como una electroforesis de proteínas séricas, para descartar trastornos hematológicos como el mieloma múltiple, que es una causa potencial de osteoporosis secundaria debido a la infiltración de las células plasmáticas en los huesos.
En aquellos pacientes en los que se sospeche un trastorno de absorción intestinal, como la enfermedad celíaca, o en los casos con síntomas gastrointestinales, se deben realizar pruebas para evaluar la presencia de malabsorción intestinal. La malabsorción crónica de nutrientes como el calcio y la vitamina D puede predisponer al desarrollo de osteoporosis y osteomalacia.
Adicionalmente, si se sospecha de tirotoxicosis (exceso de hormona tiroidea), hipogonadismo (deficiencia de hormonas sexuales), o colangitis biliar primaria (una enfermedad hepática crónica), también se deben realizar pruebas para confirmar estos diagnósticos, ya que estas condiciones pueden afectar directamente el metabolismo óseo y contribuir a la pérdida ósea.
Diagnóstico diferencial
La diagnóstico diferencial de la osteoporosis implica considerar varias condiciones que pueden presentar características clínicas similares, como la osteopenia y las fracturas, pero que tienen mecanismos subyacentes diferentes. Es fundamental distinguir entre estas entidades, ya que el tratamiento de cada una de ellas puede variar considerablemente. Entre las condiciones que pueden imitar o coexistir con la osteoporosis se encuentran la osteomalacia, las neoplasias de la médula ósea, como el mieloma múltiple, las enfermedades metastásicas óseas y la hipofosfatasia, las cuales pueden causar una disminución de la densidad ósea y predisponer a las fracturas.
Osteomalacia es una condición en la que se produce una mineralización insuficiente del hueso, a pesar de que la formación ósea y la matriz ósea (osteoid) se desarrollan con normalidad. Esta enfermedad, generalmente causada por una deficiencia prolongada de vitamina D o un trastorno en el metabolismo de esta vitamina, conduce a la debilidad de los huesos y a una mayor propensión a las fracturas. A diferencia de la osteoporosis, que implica una pérdida de masa ósea sin alteración significativa en la mineralización, la osteomalacia se caracteriza por un defecto en la mineralización ósea que puede resultar en una debilidad ósea mucho más pronunciada y en deformidades esqueléticas. Sin embargo, tanto la osteoporosis como la osteomalacia pueden presentar osteopenia (disminución de la densidad ósea) en las pruebas de densitometría ósea, lo que hace que estas dos condiciones sean difíciles de diferenciar solo a través de esta técnica. El tratamiento de la osteomalacia, por su parte, generalmente implica la corrección de los niveles de vitamina D, mientras que el tratamiento de la osteoporosis se enfoca en la mejora de la densidad ósea y la prevención de fracturas.
Las neoplasias de la médula ósea, como el mieloma múltiple, también pueden manifestarse con síntomas similares a los de la osteoporosis, tales como dolor óseo y fracturas, particularmente en las vértebras. El mieloma múltiple es un tipo de cáncer que afecta las células plasmáticas de la médula ósea y puede inducir una resorción ósea significativa debido a la liberación de proteínas que afectan directamente la actividad de las células que construyen el hueso. Esto puede llevar a la aparición de lesiones óseas líticas, que son áreas donde el hueso se ha destruido, lo que aumenta el riesgo de fracturas. Además, el mieloma múltiple puede asociarse con una disminución de la densidad ósea similar a la que se observa en la osteoporosis, lo que hace que sea difícil diferenciar ambas condiciones solo con la medición de la densidad ósea. La electroforesis de proteínas séricas es una herramienta diagnóstica clave para identificar el mieloma múltiple, ya que permite detectar proteínas anormales en la sangre que se producen debido a la proliferación de las células plasmáticas.
Por otro lado, las enfermedades metastásicas óseas también pueden causar pérdida ósea y fracturas. El cáncer que se disemina a los huesos, como el de mama, próstata, pulmón o riñón, puede inducir una resorción ósea excesiva, lo que aumenta la fragilidad ósea y el riesgo de fracturas. La presencia de lesiones metastásicas en los huesos puede ser detectada mediante técnicas de imagen, como la resonancia magnética, la tomografía computarizada o las gammagrafías óseas, las cuales pueden diferenciar las metástasis óseas de las lesiones óseas debidas a osteoporosis. Sin embargo, estas lesiones también pueden reducir la densidad ósea y hacer que los huesos sean más susceptibles a las fracturas, lo que genera superposición en la presentación clínica con la osteoporosis. La historia clínica, la evaluación de los antecedentes oncológicos y las pruebas de imagen específicas son fundamentales para hacer un diagnóstico diferencial adecuado.
La hipofosfatasia es otra enfermedad metabólica rara que también puede dar lugar a una disminución de la densidad ósea. Esta condición se caracteriza por una deficiencia en la enzima fosfatasa alcalina, que es esencial para la mineralización ósea. La falta de fosfatasa alcalina impide que el hueso se mineralice adecuadamente, lo que lleva a una fragilidad ósea similar a la observada en la osteoporosis. Al igual que en otras condiciones mencionadas, los pacientes con hipofosfatasia pueden presentar osteopenia en las pruebas de densitometría ósea, lo que dificulta la distinción de esta enfermedad de la osteoporosis. El diagnóstico de hipofosfatasia se confirma mediante la medición de los niveles de fosfatasa alcalina en suero, que en los pacientes afectados suelen estar bajos, y este diagnóstico es fundamental para dirigir el tratamiento adecuado, que generalmente incluye el reemplazo de la enzima deficiente.
Tratamiento y prevención
El manejo y la prevención de la osteoporosis no se limitan únicamente al uso de medicamentos; las medidas no farmacológicas desempeñan un papel crucial en la promoción de la salud ósea y en la reducción del riesgo de fracturas. Estas intervenciones incluyen modificaciones en la dieta, cambios en el estilo de vida y la implementación de estrategias para prevenir caídas, todas las cuales son fundamentales para mantener la densidad ósea y reducir la fragilidad ósea asociada con la osteoporosis.
En primer lugar, una dieta adecuada es esencial para la prevención y tratamiento de la osteoporosis. La ingesta adecuada de proteínas, calorías, calcio y vitamina D es fundamental para asegurar que el organismo pueda mantener la estructura ósea y minimizar la pérdida ósea. El calcio es el mineral principal que constituye la matriz ósea, por lo que un aporte insuficiente puede resultar en una mayor resorción ósea. La vitamina D, por su parte, es crucial para la absorción eficiente del calcio en el intestino y para la mineralización ósea adecuada. Su deficiencia aumenta el riesgo de osteomalacia y fracturas, incluso en pacientes con osteoporosis. Además, una ingesta adecuada de proteínas es importante porque estas son necesarias para la formación y la reparación de los tejidos óseos, y su deficiencia puede debilitar la estructura ósea, contribuyendo a la pérdida de densidad.
En cuanto a los corticosteroides, los cuales son utilizados en el tratamiento de una variedad de condiciones inflamatorias y autoinmunes, se debe intentar reducir o suspender su uso en la medida de lo posible, ya que su administración prolongada está estrechamente relacionada con la disminución de la densidad ósea y el aumento del riesgo de fracturas. Los corticosteroides, tanto en su forma oral, parenteral como inalada, pueden inducir una pérdida significativa de masa ósea al interferir con la actividad de los osteoblastos (células responsables de la formación ósea) y aumentar la actividad de los osteoclastos (células responsables de la resorción ósea). Por tanto, el uso de estos fármacos debe ser cuidadosamente monitoreado y, si es posible, reemplazado por terapias alternativas menos perjudiciales para los huesos.
El abandono del tabaquismo es una intervención fundamental en la prevención de la osteoporosis. El tabaco afecta negativamente la salud ósea de varias maneras, entre las que se incluyen la reducción de la formación ósea, la alteración de la actividad de las hormonas sexuales y la disminución de la absorción de calcio. Estos efectos combinados contribuyen a la pérdida de densidad ósea y al aumento del riesgo de fracturas. Por lo tanto, dejar de fumar es uno de los pasos más importantes que una persona puede dar para proteger su salud ósea a largo plazo.
El consumo excesivo de alcohol también debe ser evitado. El alcohol en grandes cantidades afecta negativamente la salud ósea al interferir con la formación ósea y alterar la absorción de calcio. Además, el abuso crónico de alcohol aumenta el riesgo de caídas, lo que, en combinación con huesos debilitados por la osteoporosis, puede resultar en fracturas graves. Mantener un consumo moderado o eliminar el alcohol completamente contribuye significativamente a la salud ósea y a la prevención de fracturas.
En cuanto a las actividades físicas, el ejercicio regular es altamente recomendado para mejorar tanto la densidad ósea como la fuerza muscular, reduciendo así el riesgo de fracturas debido a caídas o fraqueza ósea. Caminar es una de las actividades más accesibles y efectivas, ya que aumenta la densidad ósea en la columna vertebral y en la cadera, dos áreas comúnmente afectadas por la osteoporosis. Además, el ejercicio de resistencia, como levantar pesas o utilizar bandas elásticas, es especialmente beneficioso para fortalecer la columna vertebral, lo que puede ayudar a prevenir las fracturas vertebrales. El ejercicio también tiene un impacto positivo en el equilibrio y la coordinación, lo que puede disminuir el riesgo de caídas, un factor crucial en la prevención de fracturas en personas con osteoporosis.
Además del ejercicio, las medidas para prevenir caídas son esenciales. Una caída puede tener consecuencias devastadoras en personas con huesos frágiles, por lo que es importante reducir los riesgos de caídas en el hogar. Algunas medidas prácticas incluyen mejorar la iluminación en todas las áreas de la vivienda, especialmente en pasillos y escaleras, para evitar tropezones. La instalación de pasamanos en las escaleras y barras de apoyo en los baños puede proporcionar estabilidad adicional, lo que facilita el movimiento de las personas con osteoporosis y reduce el riesgo de caídas accidentales. La fisioterapia y los ejercicios de equilibrio también son herramientas valiosas para mejorar la estabilidad y la confianza al caminar, lo que puede ser crucial para prevenir caídas.
Los pacientes que experimentan debilidad muscular o problemas de equilibrio deben considerar el uso de bastones o andadores para mantener la estabilidad y reducir el riesgo de caídas. Además, los andadores con frenos son una opción particularmente importante, ya que permiten al usuario detenerse con seguridad y evitar caídas inesperadas al caminar. Es esencial que estos dispositivos de asistencia estén correctamente ajustados a las necesidades del paciente para garantizar su eficacia.
Es importante evitar medicamentos que puedan aumentar el riesgo de caídas, como aquellos que causan hipotensión ortostática, mareos o confusión. Estos efectos secundarios son comunes en algunos medicamentos, especialmente en los que afectan el sistema nervioso central o el sistema cardiovascular, y pueden empeorar la estabilidad del paciente, aumentando la probabilidad de caídas y fracturas.
Manejo farmacológico
El tratamiento de la osteoporosis está indicado en pacientes que presenten una pérdida significativa de la densidad ósea, lo que incrementa el riesgo de fracturas patológicas. La osteoporosis se caracteriza por una disminución en la masa ósea que afecta la integridad estructural del hueso, lo que aumenta la fragilidad ósea y la probabilidad de sufrir fracturas con traumatismos mínimos, conocidos como fracturas por fragilidad. En este contexto, el tratamiento farmacológico se justifica no solo para prevenir las fracturas, sino también para reducir la progresión de la enfermedad y mejorar la calidad de vida de los pacientes.
Para los pacientes con osteoporosis o con osteopenia y fracturas patológicas, el tratamiento es especialmente importante. En estos casos, el tratamiento se recomienda cuando el riesgo de fractura es lo suficientemente alto como para justificar la intervención. Una herramienta útil para evaluar el riesgo de fractura es el FRAX, un modelo computacional que estima la probabilidad de sufrir una fractura en los próximos diez años, tomando en cuenta factores como la densidad ósea, la edad, el sexo, el historial de fracturas previas, el consumo de tabaco y alcohol, entre otros. De acuerdo con los criterios establecidos, el tratamiento debe ser considerado en pacientes que tengan un riesgo de fractura de cadera superior al 3% o un riesgo de fractura osteoporótica mayor del 20% en los próximos diez años, según el cálculo de FRAX. Estos umbrales indican que el riesgo de sufrir fracturas en el futuro es lo suficientemente elevado como para justificar un tratamiento activo.
En los pacientes con osteoporosis severa, definida por un puntaje T en la densitometría ósea (DXA) de menos de -2.5acompañado de una fractura por fragilidad, se recomienda el uso de terapia anabólica, que busca estimular la formación ósea en lugar de reducir la resorción ósea, como ocurre con la mayoría de los tratamientos convencionales. La terapia con paratohormona (PTH), peptido similar a la paratohormona (PTHrP) o romosozumab son opciones terapéuticas para este tipo de pacientes. La PTH y el PTHrP son hormonas que desempeñan un papel crucial en la regulación del metabolismo óseo. Estas hormonas estimulan la formación ósea, promoviendo la actividad de los osteoblastos (células responsables de la formación de hueso) y ayudando a la regeneración de la matriz ósea. El romosozumab, por su parte, es un anticuerpo monoclonal que inhibe la acción de la sclerostina, una proteína que inhibe la formación ósea, lo que lleva a un aumento significativo de la formación ósea y, a su vez, mejora la densidad ósea.
Es importante señalar que el tratamiento de la osteoporosis reduce el riesgo de fracturas, pero no mejora la mortalidad general. Es decir, aunque los tratamientos farmacológicos pueden ser efectivos para disminuir la probabilidad de fracturas en pacientes con osteoporosis, no se ha demostrado que estos tratamientos tengan un impacto directo en la esperanza de vida de los pacientes. Sin embargo, la reducción de las fracturas es crucial, ya que las fracturas osteoporóticas, especialmente las fracturas de cadera, están asociadas con una alta morbilidad, discapacidad y una disminución significativa de la calidad de vida. Además, las fracturas vertebrales, aunque no siempre se reconocen inmediatamente, pueden llevar a una pérdida de altura, deformidades de la columna y dolor crónico, lo que empeora aún más la calidad de vida del paciente.
Vitamina D y calcio:
La deficiencia de vitamina D o calcio es una causa primaria de osteomalacia, una patología ósea caracterizada por una mineralización defectuosa del hueso, más que de osteoporosis, la cual se manifiesta principalmente por una reducción de la densidad ósea y alteración de la microarquitectura esquelética. No obstante, estas dos condiciones pueden coexistir en ciertos individuos y, debido a que la osteodensitometría mediante absorciometría de rayos X de energía dual (DXA) solo mide la densidad mineral ósea sin distinguir la calidad de la mineralización, no es posible diferenciarlas con esta técnica. Por ello, en la evaluación clínica y el manejo de pacientes con disminución de la masa ósea, es esencial asegurar una ingesta adecuada tanto de vitamina D como de calcio.
La vitamina D juega un papel central en la homeostasis del calcio al promover su absorción intestinal, facilitar la mineralización ósea y regular la función del paratohormona. En adultos sanos, la ingesta diaria recomendada de vitamina D se sitúa entre 600 y 800 unidades internacionales; sin embargo, alcanzar estos niveles exclusivamente a través de la dieta o la exposición solar suele ser insuficiente, especialmente en poblaciones vulnerables como personas hospitalizadas por periodos prolongados, quienes viven en residencias geriátricas, o aquellos con trastornos de malabsorción intestinal. En estos casos, la administración oral de colecalciferol (vitamina D3) en dosis de 800 a 2000 unidades internacionales diarias es una estrategia común, ajustando la dosis para mantener niveles séricos de 25-hidroxivitamina D (25-OHD) superiores o iguales a 20 nanogramos por mililitro (50 nanomoles por litro).
En individuos con mayor riesgo, como adultos mayores, embarazadas, personas con fracturas por fragilidad o con osteoporosis diagnosticada, se recomienda mantener niveles séricos de 25-OHD iguales o superiores a 30 nanogramos por mililitro (75 nanomoles por litro). Aunque es raro que se presenten toxicidades con dosis habituales, la administración de vitamina D3 en cantidades superiores a 4000 unidades internacionales diarias no se aconseja en adultos, excepto en casos específicos de malabsorción intestinal, ya que puede provocar hipercalcemia o síntomas gastrointestinales adversos. Por otro lado, existe evidencia observacional que sugiere una mayor mortalidad global tanto en niveles muy bajos como excesivamente altos de 25-OHD, lo que respalda la idea de que existe un rango terapéutico óptimo comprendido entre 30 y 50 nanogramos por mililitro (75 a 125 nanomoles por litro).
En cuanto al calcio, la ingesta diaria recomendada para adultos es de al menos 1000 miligramos, aumentando a 1200 miligramos diarios en mujeres posmenopáusicas y hombres mayores de 70 años, debido a sus mayores requerimientos osteoesqueléticos. Sin embargo, muchas personas no alcanzan este consumo a través de la dieta, y sorprendentemente, estudios prospectivos y de cohorte han demostrado que ni un alto consumo dietético de calcio ni su suplementación rutinaria están consistentemente asociados con una reducción significativa del riesgo de fracturas, especialmente de cadera o antebrazo. En mujeres posmenopáusicas con osteopenia, por ejemplo, una mayor ingesta de calcio no se tradujo en mejoras en la densidad mineral ósea, y los suplementos de calcio mostraron apenas una reducción del 14 % en la incidencia de fracturas vertebrales.
Por estas razones, la suplementación con calcio no se recomienda de manera generalizada en personas sanas u osteopénicas. Se reserva para aquellos con una dieta pobre en calcio —ya sea por bajo consumo de lácteos, vegetales de hojas verdes oscuras, sardinas, tofu o alimentos fortificados— o en personas con alteraciones en la absorción intestinal. Existen diferentes formulaciones de calcio disponibles; el citrato de calcio es preferido en pacientes que utilizan inhibidores de la secreción ácida gástrica, ya que no requiere un ambiente ácido para su absorción. Por su parte, el carbonato de calcio debe ingerirse con alimentos para mejorar su biodisponibilidad. Los suplementos de calcio suelen combinarse con vitamina D3 para optimizar la absorción intestinal y el efecto osteoprotector conjunto. Aunque generalmente son bien tolerados, pueden causar efectos gastrointestinales como distensión abdominal y estreñimiento. Finalmente, para minimizar el riesgo de nefrolitiasis, se recomienda ingerir los suplementos de calcio junto con las comidas.
Hormonas sexuales
Las hormonas sexuales desempeñan un papel esencial en el mantenimiento de la salud ósea, y su deficiencia, ya sea en mujeres o en varones, constituye un factor de riesgo significativo para el desarrollo de osteoporosis. La fisiología ósea depende de un equilibrio entre la formación y la resorción del tejido óseo, proceso que está finamente regulado por señales hormonales, entre las cuales destacan los estrógenos y los andrógenos. Estas hormonas ejercen un efecto protector sobre el esqueleto al inhibir la actividad de los osteoclastos —células responsables de la resorción ósea— y al promover la supervivencia y función de los osteoblastos —células encargadas de la formación de hueso—. Por tanto, la deficiencia hormonal, como ocurre en situaciones de hipogonadismo, conlleva una aceleración de la pérdida de masa ósea, aumentando el riesgo de fracturas por fragilidad.
En este contexto, la terapia de reemplazo hormonal puede desempeñar un papel importante como medida preventiva en individuos con hipogonadismo. En mujeres, especialmente en aquellas con hipogonadismo primario o secundario, como es el caso de jóvenes con amenorrea hipotalámica secundaria a trastornos alimentarios como la anorexia nerviosa, la administración de estrógenos en dosis bajas por vía transdérmica ha demostrado ser eficaz en la prevención de la pérdida ósea. Este enfoque terapéutico restituye el ambiente hormonal necesario para el mantenimiento del metabolismo óseo sin inducir los efectos adversos asociados a dosis más elevadas de estrógenos, como el aumento del riesgo tromboembólico o neoplásico. Sin embargo, es importante destacar que esta intervención tiene un valor principalmente profiláctico: previene la aparición de osteoporosis en mujeres con deficiencia estrogénica, pero no constituye una terapia eficaz para revertir la osteoporosis una vez establecida.
En los varones, una situación análoga se presenta en el contexto de hipogonadismo, caracterizado por niveles séricos bajos de testosterona. La testosterona cumple funciones esenciales en la salud ósea masculina, tanto por sus efectos directos sobre los receptores androgénicos presentes en el tejido óseo, como por su conversión periférica en estradiol, que también ejerce efectos antiresortivos. En hombres con deficiencia severa de testosterona, la terapia de reemplazo con testosterona o con estradiol transdérmico en dosis bajas puede restaurar los niveles hormonales fisiológicos, previniendo así la disminución de la densidad mineral ósea. Al igual que en mujeres, este tratamiento es efectivo como medida preventiva, pero no ha demostrado una eficacia suficiente como tratamiento de la osteoporosis ya instalada.
Cabe resaltar que, en ambos sexos, la utilización de hormonas sexuales debe individualizarse cuidadosamente, considerando factores de riesgo, contraindicaciones y el perfil de efectos secundarios. Asimismo, cuando se trata de pacientes con osteoporosis manifiesta, el tratamiento debe orientarse hacia agentes específicos que han demostrado eficacia en la reducción del riesgo de fracturas, como los bifosfonatos, los moduladores selectivos de los receptores de estrógeno, los anticuerpos monoclonales contra el ligando RANK, o los agentes anabólicos como la teriparatida. En resumen, el reemplazo hormonal con estrógenos en mujeres hipogonadales y con testosterona en varones hipogonadales es útil para prevenir la aparición de osteoporosis, pero no se considera una terapia apropiada para su tratamiento una vez que la enfermedad está establecida.
Moduladores selectivos del receptor de estrógeno
Los moduladores selectivos del receptor de estrógeno, conocidos como SERMs por sus siglas en inglés, constituyen una clase farmacológica diseñada para imitar los efectos beneficiosos del estrógeno sobre ciertos tejidos, como el tejido óseo, al mismo tiempo que antagonizan su acción en otros órganos, como las mamas y el endometrio. Esta capacidad de actuar como agonistas o antagonistas tisulares específicos se basa en su interacción con los receptores de estrógeno alfa y beta, así como en la conformación del complejo receptor-ligando que se forma, lo cual influye en la activación o represión de genes regulados por estrógenos.
Desde el punto de vista clínico, los SERMs pueden ser utilizados eficazmente para prevenir la pérdida de masa ósea en mujeres posmenopáusicas, pero su utilidad como tratamiento de la osteoporosis ya establecida es limitada. Uno de los agentes más estudiados en este grupo es raloxifeno, un SERM de segunda generación que se administra por vía oral a dosis de 60 miligramos diarios. En mujeres posmenopáusicas, raloxifeno ha demostrado aumentar la densidad mineral ósea aproximadamente un 1 % en un periodo de dos años, en comparación con un aumento del 2 % observado con la terapia de reemplazo estrogénico. Esta ganancia modesta en densidad ósea se asocia con una reducción del 40 % en el riesgo de fracturas vertebrales, lo cual sugiere un beneficio clínico importante en la prevención de las fracturas más relacionadas con el colapso trabecular. Sin embargo, no se ha observado una reducción significativa en el riesgo de fracturas no vertebrales, como las de cadera o muñeca, lo cual limita su indicación en pacientes con osteoporosis avanzada o con alto riesgo de fracturas múltiples.
Raloxifeno presenta un perfil de seguridad diferente al de los estrógenos. A diferencia de estos, no estimula el endometrio y, por lo tanto, no se asocia con hiperplasia endometrial, sangrado uterino anormal ni riesgo incrementado de cáncer de endometrio. Tampoco mitiga los síntomas vasomotores típicos de la menopausia, como los sofocos, ni mejora la sequedad vaginal. De hecho, puede empeorar los sofocos en algunas mujeres. No obstante, uno de sus efectos más destacados es la notable reducción del riesgo de cáncer de mama. En estudios clínicos, el uso de raloxifeno durante tres años redujo el riesgo de cáncer de mama invasivo en un 76 %, lo que representa una ventaja considerable en mujeres posmenopáusicas con riesgo elevado de esta neoplasia.
A pesar de sus beneficios, raloxifeno no está exento de riesgos. Al igual que los estrógenos, incrementa la incidencia de eventos tromboembólicos venosos, como trombosis venosa profunda y embolismo pulmonar, por lo que está contraindicado en mujeres con antecedentes de tromboembolismo o con factores de riesgo significativos para estas complicaciones. Además, debido a su potencial teratogénico, su uso está relativamente contraindicado en mujeres premenopáusicas que aún pueden concebir.
Otro SERM con aplicación clínica es tamoxifeno, ampliamente utilizado en el tratamiento adyuvante de mujeres con cáncer de mama receptor de estrógeno positivo. Sin embargo, su efecto sobre el tejido óseo depende del estado hormonal de la paciente. En mujeres premenopáusicas, tamoxifeno puede inducir una pérdida progresiva de densidad mineral ósea vertebral, del orden de –1.44 % anual, debido a su acción antagonista sobre los receptores estrogénicos en presencia de altos niveles endógenos de estrógeno. Por el contrario, en mujeres posmenopáusicas, donde la acción estrogénica endógena es reducida, tamoxifeno actúa como agonista parcial, aumentando la densidad ósea vertebral en aproximadamente 1.17 % anual.
Finalmente, existe una formulación combinada que incorpora conjugados estrogénicos con un SERM, específicamente bazedoxifeno, en un producto de dosis fija aprobado para la prevención de la osteoporosis en mujeres posmenopáusicas con útero intacto. Esta combinación, disponible comercialmente como Duavee, ofrece los beneficios del estrógeno sobre los huesos y el control de síntomas menopáusicos, mientras que el bazedoxifeno contrarresta los efectos estimulantes del estrógeno sobre el endometrio. No obstante, a diferencia del raloxifeno, bazedoxifeno no ha demostrado reducir el riesgo de cáncer de mama. Además, su uso prolongado se ha asociado con un aumento del riesgo de eventos tromboembólicos, por lo que su indicación debe realizarse con precaución y en pacientes cuidadosamente seleccionadas.
Calcitonina
La calcitonina es una hormona polipeptídica producida principalmente por las células parafoliculares (células C) de la glándula tiroides en los mamíferos. Su función fisiológica consiste en la regulación del metabolismo del calcio, actuando principalmente como un agente hipocalcemiante al inhibir la actividad de los osteoclastos, las células responsables de la resorción ósea. Sin embargo, en la práctica clínica, la forma más utilizada de calcitonina es la derivada del salmón, que presenta mayor potencia y una vida media más prolongada que la humana, lo cual la hace más eficaz para su uso terapéutico.
Actualmente, la principal indicación clínica de la calcitonina de salmón por vía intranasal no se centra en la prevención ni en el tratamiento a largo plazo de la osteoporosis, sino en el manejo del dolor asociado a fracturas vertebrales agudas por compresión, particularmente en el contexto de osteoporosis postmenopáusica. En estas circunstancias, la administración de calcitonina puede ejercer un efecto analgésico notable. Aunque los mecanismos exactos por los cuales se produce esta analgesia no están completamente esclarecidos, se postula que la calcitonina actúa sobre receptores en el sistema nervioso central involucrados en la modulación del dolor, además de su efecto periférico en la inhibición de la resorción ósea que podría contribuir a reducir la inflamación local secundaria a la fractura.
El inicio del efecto analgésico suele observarse dentro de un periodo de dos a cuatro semanas desde el inicio del tratamiento, y, en aquellos pacientes que responden favorablemente, se puede continuar la administración por un máximo de tres meses, tiempo suficiente para que el dolor agudo ceda y se alcance una etapa más estable del proceso de consolidación ósea. La dosificación típica consiste en un espray nasal de 200 unidades internacionales, administrado una vez al día, alternando las ventanas nasales para minimizar la irritación local.
No obstante, el uso de calcitonina nasal no está exento de efectos adversos. Las reacciones locales en la mucosa nasal son comunes y se manifiestan frecuentemente como rinitis o epistaxis, lo cual puede limitar su tolerancia en algunos pacientes. Más preocupante, sin embargo, es la asociación documentada entre el uso prolongado de calcitonina y un incremento leve pero estadísticamente significativo en el riesgo de desarrollar neoplasias malignas. Estudios clínicos y metaanálisis han sugerido un aumento del riesgo de cáncer del orden del 1.1 % en pacientes tratados con calcitonina, lo que ha suscitado preocupaciones regulatorias importantes.
Como resultado de esta asociación con riesgo oncológico, y dado que su eficacia como agente antiresortivo es significativamente inferior a la de otros tratamientos disponibles para la osteoporosis, la calcitonina ha sido retirada del mercado en diversos países, incluidos Canadá y naciones de la Unión Europea. En esos contextos, las autoridades sanitarias han considerado que los riesgos superan los beneficios potenciales, particularmente cuando existen alternativas más eficaces y seguras para la prevención de fracturas osteoporóticas y el manejo del dolor crónico.
Bifosfonatos
Los bisfosfonatos constituyen uno de los pilares fundamentales en el tratamiento farmacológico de la osteoporosis, particularmente en pacientes con evidencia densitométrica de osteoporosis en la columna vertebral, cadera total o cuello femoral, así como en aquellos con antecedentes de fractura vertebral patológica o fractura de cadera secundaria a traumatismos de bajo impacto. Su uso también está bien establecido en la prevención de la pérdida ósea inducida por glucocorticoides, lo cual los convierte en una opción terapéutica de amplio espectro en diversas formas de osteoporosis.
El mecanismo de acción de los bisfosfonatos se basa en su afinidad por el hidroxiapatita ósea, donde se incorporan activamente durante los procesos de remodelación esquelética. Una vez internalizados por los osteoclastos durante la resorción ósea, los bisfosfonatos inhiben funciones celulares fundamentales como la organización del citoesqueleto, la producción de protones y enzimas lisosomales, e incluso inducen apoptosis osteoclástica. Esta inhibición directa de la resorción ósea reduce el recambio óseo y permite una ganancia neta de masa ósea con el tiempo. Como resultado, los bisfosfonatos aumentan significativamente la densidad mineral ósea y reducen el riesgo de fracturas vertebrales en todos los estudios clínicos. Además, todos los bisfosfonatos, con excepción de ibandronato, han demostrado ser efectivos en la reducción del riesgo de fracturas no vertebrales.
Los bisfosfonatos pueden administrarse por vía oral o intravenosa, lo que permite adaptarlos a las necesidades clínicas y características individuales del paciente. Las formulaciones orales incluyen alendronato, risedronato e ibandronato. La administración oral requiere medidas estrictas para optimizar la absorción intestinal y minimizar los efectos adversos gastrointestinales: deben tomarse en ayunas, en la mañana, con al menos 240 mililitros de agua simple, y el paciente debe permanecer en posición erguida durante al menos 40 minutos antes de ingerir alimentos u otros medicamentos. Estas precauciones buscan evitar la esofagitis y otras complicaciones esofágicas, que pueden ser severas, especialmente en personas con hernia hiatal o enfermedad por reflujo gastroesofágico.
En cuanto a la duración del tratamiento, los bisfosfonatos se acumulan en el tejido óseo y tienen una vida media prolongada, estimada en aproximadamente 10 años. Esta característica permite que, después de un curso de tratamiento de tres a cinco años, se considere una interrupción temporal o “vacaciones terapéuticas” en pacientes cuyo riesgo de fractura se haya reducido y cuyo puntaje T se haya elevado por encima de –2.5. En estos casos, se puede suspender el medicamento por un periodo de tres a cinco años, bajo monitoreo clínico y densitométrico. No obstante, en pacientes con osteoporosis persistente y alto riesgo de fracturas, el tratamiento puede extenderse por dos años adicionales. El límite de tratamiento se justifica, entre otros motivos, por la asociación con fracturas femorales atípicas tras uso prolongado.
Cada bisfosfonato tiene características farmacológicas distintas. Alendronato, por ejemplo, se administra una vez por semana en dosis de 70 miligramos, y existe una formulación efervescente con un perfil más favorable para pacientes con dificultad para tragar o con riesgo de irritación esofágica. Risedronato puede administrarse una vez al mes (150 miligramos), y por su menor vida media ósea, es preferido en mujeres en edad fértil. Aunque ambos agentes reducen el riesgo de fracturas vertebrales, alendronato parece tener una eficacia superior en la prevención de fracturas no vertebrales. Ibandronato, también de administración mensual oral, reduce el riesgo de fracturas vertebrales, pero no ha demostrado eficacia en fracturas no vertebrales.
Para pacientes que no toleran la vía oral o tienen contraindicaciones gastrointestinales, los bisfosfonatos intravenosos como ácido zoledrónico y pamidronato constituyen una alternativa efectiva. El ácido zoledrónico, en particular, es un potente inhibidor osteoclástico que se administra en dosis de 5 miligramos por infusión intravenosa lenta (durante 15 a 30 minutos) una vez al año. En estudios clínicos, el ácido zoledrónico anual ha demostrado reducir las fracturas de cadera en un 41 % y las fracturas vertebrales clínicas en un 77 % a tres años. No obstante, puede producir una reacción adversa conocida como “respuesta de fase aguda”, especialmente tras la primera infusión. Esta reacción ocurre en hasta el 42 % de los pacientes y se caracteriza por fiebre, escalofríos, rubor, mialgias, náuseas, fatiga y, en casos raros, inflamación ocular. Estos síntomas son generalmente transitorios, autolimitados, y pueden aliviarse con paracetamol, antiinflamatorios no esteroideos, o en casos más severos, corticosteroides profilácticos y antieméticos como ondansetrón. La intensidad de esta respuesta disminuye con las dosis subsecuentes y es menos frecuente con pamidronato, el cual puede considerarse en pacientes con sensibilidad a zoledrónico.
Cabe mencionar que los bisfosfonatos están contraindicados en pacientes con deterioro renal avanzado, particularmente con un aclaramiento de creatinina menor a 35 mililitros por minuto, debido al riesgo de toxicidad renal y acumulación del fármaco. Asimismo, es importante informar al paciente que, durante el primer año de tratamiento, aproximadamente el 18 % puede experimentar una pérdida inicial de densidad mineral ósea, atribuible a la reducción del recambio óseo; sin embargo, el 80 % de estos individuos presenta un incremento neto en la densidad ósea con el tratamiento continuado.
La osteonecrosis de la mandíbula es una complicación poco frecuente, pero clínicamente relevante, del tratamiento con bisfosfonatos. Se caracteriza por la presencia de una lesión necrótica, dolorosa y no cicatrizante que afecta al maxilar o la mandíbula, y cuya aparición suele estar asociada a procedimientos dentales invasivos, en particular extracciones dentales. Esta condición representa una forma localizada de necrosis ósea, cuyo mecanismo fisiopatológico se relaciona con la supresión del recambio óseo inducida por los bisfosfonatos, que inhiben la resorción ósea mediante la apoptosis de los osteoclastos y la alteración de su función.
En condiciones fisiológicas, el hueso maxilofacial presenta una tasa de remodelación ósea relativamente alta debido a las fuerzas mecánicas asociadas con la masticación y a la proximidad de tejidos ricos en bacterias, como la mucosa oral. Esta alta tasa de recambio lo hace más susceptible a los efectos inhibitorios prolongados de los bisfosfonatos. Al suprimir la renovación ósea, estos fármacos reducen la capacidad del hueso para reparar microdaños o responder a agresiones locales, como las que se producen durante procedimientos dentales invasivos. La consecuencia de esta disfunción es la pérdida de vitalidad ósea, colonización bacteriana y exposición persistente del hueso necrótico a través de la mucosa oral.
El riesgo de desarrollar osteonecrosis mandibular se incrementa con la edad avanzada, en mujeres, y en pacientes que reciben tratamientos concomitantes con quimioterapia o corticosteroides, factores que también comprometen la regeneración tisular o la respuesta inmunológica. Sin embargo, el factor de riesgo más determinante es la dosis y vía de administración del bisfosfonato. Aproximadamente el 95 % de los casos de osteonecrosis de mandíbula se han documentado en pacientes que reciben bisfosfonatos por vía intravenosa en dosis altas, especialmente ácido zoledrónico o pamidronato, con fines oncológicos en el contexto de metástasis osteolíticas. En contraste, los casos asociados al tratamiento de la osteoporosis con bisfosfonatos orales o con infusiones intravenosas anuales de ácido zoledrónico representan solo el 5 % de los reportes, reflejando una diferencia significativa en la incidencia y en el riesgo acumulado.
La incidencia estimada de osteonecrosis mandibular en pacientes tratados con bisfosfonatos orales para osteoporosis es de aproximadamente uno por cada 100,000 pacientes tratados, mientras que en pacientes oncológicos que reciben altas dosis por vía intravenosa, la incidencia puede alcanzar uno por cada 100. Esta diferencia subraya que el riesgo absoluto en el tratamiento osteoporótico es muy bajo, aunque no despreciable.
Un método propuesto para estratificar el riesgo de osteonecrosis mandibular en pacientes que deben someterse a cirugía dental es la medición del nivel sérico del telopéptido C-terminal del colágeno tipo I (C-telopeptido), un marcador de resorción ósea que se reduce significativamente con el uso de bisfosfonatos. Niveles séricos de C-telopeptido superiores o iguales a 150 picogramos por mililitro indican un riesgo mínimo, entre 100 y 149 picogramos por mililitro un riesgo moderado, y niveles inferiores a 100 picogramos por mililitro un riesgo elevado. Aunque esta herramienta no es diagnóstica, puede orientar decisiones clínicas respecto a la planificación quirúrgica.
La prevención de esta complicación incluye el seguimiento odontológico regular y la evitación de procedimientos invasivos durante el tratamiento con bisfosfonatos. En casos donde la cirugía dental sea inevitable, se recomienda interrumpir el tratamiento con bisfosfonatos aproximadamente tres meses antes del procedimiento y reanudarlo un mes después, siempre y cuando haya evidencia de adecuada cicatrización ósea.
Además de la osteonecrosis mandibular, los bisfosfonatos se han asociado a otro efecto adverso poco común, pero importante: las fracturas atípicas de fémur. Estas fracturas de bajo impacto, también llamadas «en tallo de tiza», afectan el tercio medio o subtrocantéreo del fémur y presentan una morfología transversal, sinmúltiples fragmentos. Se han reportado predominantemente en mujeres asiáticas, en pacientes tratados con bisfosfonatos durante más de cinco años, y en aquellos con uso concomitante de corticosteroides. El riesgo relativo de estas fracturas es aproximadamente 4.8 veces mayor en mujeres asiáticas en comparación con mujeres blancas. Estudios han identificado que, en mujeres posmenopáusicas tratadas con bisfosfonatos durante cinco años o más, la incidencia de fractura subtrocantérea fue de 0.22 % en los siguientes dos años, y un 27 % de estos casos presentaron fracturas bilaterales. Además, cerca del 70 % de los pacientes reportaron dolor en el muslo semanas o meses antes del evento fracturario, lo cual sugiere una ventana de oportunidad para la intervención temprana.
A pesar de estas complicaciones, el balance riesgo-beneficio sigue siendo ampliamente favorable para los bisfosfonatos en la mayoría de los pacientes. Por ejemplo, en mujeres blancas que toman bisfosfonatos durante tres años, se previenen aproximadamente 149 fracturas de cadera por cada 10,000 tratadas, en comparación con apenas dos fracturas femorales atípicas. En mujeres asiáticas, la relación es menos favorable, pero aún positiva: 91 fracturas de cadera prevenidas por cada 8 fracturas atípicas.
Se debe tener en cuenta que los bisfosfonatos, al suprimir la resorción ósea, pueden inducir hipocalcemia, la cual estimula la secreción de hormona paratiroidea y puede simular un cuadro de hiperparatiroidismo primario. Hasta el 20 % de los pacientes tratados con bisfosfonatos pueden presentar hipocalcemia, y en el 10 % se observa un aumento de la hormona paratiroidea por encima del rango normal. El tratamiento de este efecto consiste en la suplementación con sales de calcio (500 a 1000 miligramos diarios) y vitamina D3 (al menos 1000 unidades diarias), especialmente al inicio del tratamiento.
Denosumab
Denosumab es un anticuerpo monoclonal humano que actúa específicamente contra el receptor activador del factor nuclear kappa-B ligando (RANKL), una citocina esencial para la diferenciación, proliferación y supervivencia de los osteoclastos. Al bloquear la unión de RANKL con su receptor RANK en la superficie de los precursores osteoclásticos, denosumab inhibe de manera eficaz la formación de osteoclastos maduros, reduciendo significativamente la resorción ósea y, por ende, el recambio óseo. Esta acción lo convierte en un potente agente antiresortivo que modifica el curso de la osteoporosis y otras condiciones de fragilidad ósea.
Denosumab está indicado tanto en mujeres como en hombres para el tratamiento de la osteoporosis establecida, especialmente en quienes han sufrido fracturas por fragilidad o presentan osteopenia con un puntaje elevado en la herramienta FRAX, que estima el riesgo a 10 años de fractura. También se utiliza en pacientes con alto riesgo de fractura secundaria a la supresión hormonal inducida por tratamientos para el cáncer de mama o próstata, dado que estos esquemas terapéuticos aceleran la pérdida de masa ósea.
La eficacia antifractura de denosumab ha sido ampliamente validada. Reduce el riesgo de fracturas vertebrales en un 68 % y de fracturas de cadera en un 40 %, lo cual lo posiciona como uno de los tratamientos más efectivos disponibles. Se administra por vía subcutánea en una dosis fija de 60 miligramos cada seis meses, lo que favorece la adherencia terapéutica y evita los requerimientos estrictos de administración que presentan los bisfosfonatos orales.
En términos de eficacia densitométrica, denosumab ha demostrado ser superior a los bisfosfonatos orales para aumentar la densidad mineral ósea en la columna vertebral, el fémur total y el cuello femoral, así como para reducir el riesgo de fracturas tras dos años de tratamiento. Comparado con el ácido zoledrónico intravenoso, denosumab muestra una mayor capacidad para incrementar la densidad en el fémur total y el cuello femoral, aunque ambos agentes tienen efectos comparables en la densidad de la columna vertebral.
Desde el punto de vista de la tolerancia, denosumab ha mostrado un perfil generalmente favorable, con efectos adversos leves como síntomas seudogripales en aproximadamente un 8 % de los pacientes. Sin embargo, uno de los efectos adversos más importantes es la hipocalcemia, dado que la reducción de la resorción ósea disminuye también la liberación de calcio al torrente sanguíneo. Por este motivo, el tratamiento con denosumab está contraindicado en pacientes con hipocalcemia no corregida. A diferencia de los bisfosfonatos, que están contraindicados en insuficiencia renal avanzada, denosumab puede utilizarse en pacientes con enfermedad renal crónica grave, lo que representa una ventaja en teoría. No obstante, estudios recientes han demostrado que su uso en este grupo de pacientes conlleva riesgos importantes.
Un estudio retrospectivo a gran escala publicado en 2024 alertó sobre una alta incidencia de hipocalcemia severa (niveles séricos inferiores a 7.5 mg/dL) en pacientes en diálisis que recibían denosumab, con eventos potencialmente mortales, hospitalizaciones e incluso muertes. La incidencia fue del 41 % en pacientes tratados con denosumab, comparada con solo el 2 % en aquellos tratados con bisfosfonatos orales. Esta evidencia llevó a la Administración de Alimentos y Medicamentos (FDA) a emitir una advertencia de “caja negra” sobre el uso de denosumab en pacientes con enfermedad renal crónica avanzada, especialmente en presencia de trastornos minerales óseos asociados a la insuficiencia renal.
El uso de denosumab en mujeres premenopáusicas requiere extrema precaución. Estudios preclínicos han demostrado efectos teratogénicos en modelos animales, por lo que se recomienda un método anticonceptivo eficaz durante su administración en mujeres en edad fértil.
A largo plazo, denosumab comparte algunas de las complicaciones asociadas con los bisfosfonatos, como las fracturas atípicas del fémur y la osteonecrosis de la mandíbula, especialmente cuando se utiliza por periodos prolongados o en combinación con otros agentes antiresortivos.
Una de las características más distintivas de denosumab es que sus efectos desaparecen rápidamente tras la suspensión del tratamiento. A diferencia de los bisfosfonatos, que se acumulan en el tejido óseo y mantienen cierto efecto residual durante meses o años, los niveles séricos de denosumab caen de forma abrupta a los seis meses de la última dosis. Como consecuencia, la resorción ósea se reactiva rápidamente, y puede ocurrir una pérdida acelerada de masa ósea, acompañada de un marcado aumento en el riesgo de fracturas vertebrales múltiples dentro del primer o segundo año posterior a su discontinuación. Esta particularidad implica que el tratamiento con denosumab no admite “vacaciones terapéuticas” como sucede con los bisfosfonatos, y debe mantenerse con estricta regularidad.
Si se decide interrumpir el tratamiento, es imprescindible iniciar inmediatamente otro agente antiresortivo —como un bisfosfonato, estradiol o un modulador selectivo del receptor estrogénico— para preservar la densidad ósea alcanzada y prevenir fracturas por rebote.
Análogos de la hormona paratiroidea
Los análogos de la hormona paratiroidea (PTH) y de la proteína relacionada con la hormona paratiroidea (PTHrP), como la teriparatida y el abaloparatida, representan una clase terapéutica innovadora y fundamentalmente distinta de los agentes antiresortivos convencionales en el tratamiento de la osteoporosis. A diferencia de los bisfosfonatos o del denosumab, cuyo mecanismo de acción se basa en la inhibición de la resorción ósea, los análogos de PTH y PTHrP ejercen un efecto anabólico, estimulando activamente la formación de nuevo tejido óseo.
Estas moléculas son fragmentos sintéticos de las proteínas endógenas PTH y PTHrP, que activan el receptor de PTH en osteoblastos cuando se administran de forma intermitente (una vez al día por vía subcutánea). Esta activación episódica induce la proliferación y diferenciación de osteoblastos, así como la síntesis de matriz ósea colágena nueva, especialmente en el hueso trabecular de las vértebras. Posteriormente, esta matriz debe mineralizarse para que se traduzca en un aumento real de la densidad mineral ósea. La administración continua, en cambio, tendría un efecto catabólico, similar al observado en el hiperparatiroidismo primario, por lo que la pauta diaria y limitada en el tiempo es esencial para lograr los efectos deseados.
La teriparatida (dosis diaria de 20 o 40 microgramos) y el abaloparatida (dosis diaria de 80 microgramos) están aprobados exclusivamente para pacientes con osteoporosis severa y riesgo de fractura extremadamente alto, especialmente aquellos con antecedentes de fracturas vertebrales múltiples o graves. Dado su potente efecto anabólico, estos medicamentos son capaces de incrementar de manera significativa la densidad mineral ósea en múltiples regiones del esqueleto, con excepción del radio distal, que responde de manera más modesta. Además, tienen un papel terapéutico emergente en la promoción de la consolidación ósea en fracturas atípicas del fémur, relacionadas con el uso prolongado de bisfosfonatos, dado que favorecen la regeneración ósea activa en sitios de estrés esquelético.
Es indispensable asegurar un aporte adecuado de calcio y vitamina D durante el tratamiento con estos agentes, ya que el proceso anabólico que inducen requiere una disponibilidad suficiente de estos elementos para la correcta mineralización de la matriz ósea recién formada. En ausencia de estos cofactores, el efecto terapéutico puede verse limitado y existe un mayor riesgo de hipocalcemia funcional secundaria.
El uso clínico de estos medicamentos está limitado a un curso máximo de dos años a lo largo de la vida del paciente, debido a la evidencia preclínica de formación de osteosarcomas en ratas tratadas con dosis elevadas y durante períodos prolongados. Aunque este hallazgo no se ha reproducido en humanos, constituye la base de una importante precaución regulatoria. Por lo tanto, pacientes con factores de riesgo conocidos para osteosarcoma —como enfermedad ósea de Paget, elevación inexplicada de la fosfatasa alcalina sérica, antecedentes de radioterapia ósea, presencia de epífisis abiertas o antecedentes personales de osteosarcoma o condrosarcoma— no deben recibir teriparatida ni abaloparatida.
Un efecto adverso clínicamente relevante es la hipercalcemia, que puede manifestarse como náuseas, constipación, astenia o debilidad muscular. Este riesgo es mayor en pacientes que toman simultáneamente suplementos de calcio, corticosteroides o diuréticos tiazídicos, debido a la interacción de estos medicamentos con el metabolismo del calcio. Por ello, se recomienda una monitorización periódica de los niveles séricos de calcio durante el tratamiento.
Una vez finalizado el curso de dos años de tratamiento con teriparatida o abaloparatida, es crucial iniciar inmediatamente un agente antiresortivo —como un bisfosfonato o denosumab— con el fin de conservar la densidad ósea ganada. Esta estrategia secuencial aprovecha el efecto anabólico inicial y lo estabiliza con un agente que reduce la resorción, asegurando así un beneficio sostenido a largo plazo. La inversión de esta secuencia (usar primero un antiresortivo) no ofrece los mismos resultados, ya que los antiresortivos disminuyen la actividad osteoblástica, interfiriendo con el efecto posterior del agente anabólico.
En situaciones de osteoporosis extremadamente severa, se ha explorado la combinación simultánea de teriparatida o abaloparatida con denosumab. Esta terapia dual ha demostrado una mejora superior en la densidad ósea y una mayor reducción del riesgo de fractura en comparación con cualquier monoterapia, aunque se ha observado un aumento en la incidencia de efectos adversos como fatiga, dolor articular y náuseas.
Romosozumab
Romosozumab es un anticuerpo monoclonal humanizado que representa una de las innovaciones más recientes en el tratamiento de la osteoporosis, debido a su mecanismo de acción dual único: promueve simultáneamente la formación de hueso nuevo y reduce la resorción ósea. Su objetivo terapéutico es la esclerostina, una glucoproteína producida por los osteocitos que actúa como un potente inhibidor de la actividad osteoblástica. Al bloquear la esclerostina, romosozumab libera el freno fisiológico sobre los osteoblastos, estimulando la síntesis de matriz ósea, al mismo tiempo que reduce indirectamente la actividad de los osteoclastos y, por ende, la resorción ósea.
Este efecto combinado —anabólico y antiresortivo— lo distingue tanto de los agentes netamente anabólicos como la teriparatida o el abaloparatida, como de los antiresortivos clásicos como los bisfosfonatos o el denosumab. Como resultado, romosozumab produce incrementos más rápidos y sustanciales en la densidad mineral ósea, particularmente en regiones trabeculares como la columna vertebral y en el hueso cortical del fémur proximal, una característica crítica en la prevención de fracturas osteoporóticas.
En estudios clínicos de gran envergadura, particularmente en mujeres posmenopáusicas con osteoporosis severa y antecedentes de fracturas por fragilidad, romosozumab administrado durante 12 meses, seguido de un curso de alendronato durante otros 12 meses, redujo significativamente el riesgo de nuevas fracturas. En comparación con la administración exclusiva de alendronato, esta estrategia secuencial logró una reducción del 48 % en la incidencia de fracturas vertebrales y del 38 % en el riesgo de fractura de cadera. Estos datos confirman que el tratamiento inicial con romosozumab, al inducir una rápida ganancia de masa ósea, puede establecer una base estructural sólida que luego puede ser estabilizada con un agente antiresortivo de acción prolongada como el alendronato.
Debido a su potencia y perfil de acción, romosozumab está reservado para pacientes con osteoporosis muy severa, en particular aquellos con múltiples fracturas vertebrales o con un riesgo extremadamente alto de fractura según herramientas como el índice FRAX. No se recomienda su uso en pacientes con osteoporosis leve o moderada, ni como terapia de primera línea en casos de bajo riesgo.
Un aspecto crítico a considerar en la indicación de romosozumab es su potencial efecto adverso cardiovascular. Aunque en la mayoría de los pacientes el fármaco se tolera adecuadamente, los ensayos clínicos han mostrado una ligera pero estadísticamente significativa mayor incidencia de eventos cardiovasculares adversos mayores —como infarto agudo de miocardio o accidente cerebrovascular isquémico— en comparación con grupos de control tratados con alendronato. Aunque la fisiopatología detrás de este riesgo no está completamente dilucidada, se ha planteado que la inhibición de la esclerostina podría tener efectos colaterales en la homeostasis vascular, ya que esta proteína también se expresa en tejidos extracelulares no óseos. Por ello, su uso debe limitarse estrictamente a pacientes con bajo riesgo cardiovascular, evitando su administración en aquellos con antecedentes recientes de infarto, accidente cerebrovascular, enfermedad arterial periférica grave o insuficiencia cardíaca avanzada.
Romosozumab se administra en una dosis de 210 miligramos por vía subcutánea una vez al mes durante un máximo de 12 meses. Su uso está limitado a este periodo debido a que su efecto anabólico parece alcanzar un umbral de eficacia tras un año, y prolongar su uso más allá de ese punto no ha demostrado beneficios adicionales significativos, mientras que el riesgo de efectos adversos podría incrementarse.
Como ocurre con todos los tratamientos anabólicos, es esencial que tras la finalización del curso con romosozumab, el paciente inicie inmediatamente un agente antiresortivo para consolidar la ganancia ósea obtenida y evitar una rápida reversión del efecto beneficioso. Sin esta transición terapéutica, el hueso recién formado puede ser vulnerable a la resorción, lo que anularía los avances logrados en la prevención de fracturas.
Pronóstico
La osteoporosis es una enfermedad esquelética crónica caracterizada por una disminución progresiva de la densidad mineral ósea y una alteración de la microarquitectura del tejido óseo, lo que conduce a una fragilidad ósea aumentada y, en consecuencia, a un riesgo significativamente elevado de fracturas, particularmente en vértebras, cadera y radio distal. A pesar de los avances en su tratamiento farmacológico, la osteoporosis solo puede ser revertida parcialmente una vez instaurada, razón por la cual la prevención representa la estrategia más eficaz y racional desde el punto de vista clínico, funcional y económico.
El hueso humano experimenta una continua remodelación a lo largo de la vida, en la que se equilibran la resorción osteoclástica y la formación osteoblástica. Este equilibrio tiende a romperse a partir de la tercera década de vida, cuando la masa ósea alcanza su pico máximo y posteriormente comienza un proceso gradual de pérdida. Factores como el envejecimiento, la menopausia, la hipogonadismo, el sedentarismo, la desnutrición, el déficit de vitamina D, la baja ingesta de calcio, el tabaquismo, el consumo excesivo de alcohol, y el uso prolongado de glucocorticoides o inhibidores hormonales aumentan el riesgo de una pérdida ósea acelerada.
Una vez establecida la osteoporosis, los tratamientos disponibles —que incluyen fármacos antiresortivos como los bisfosfonatos y el denosumab, o anabólicos como los análogos de la hormona paratiroidea o el romosozumab— pueden lograr incrementos significativos en la densidad mineral ósea y reducciones sustanciales del riesgo de fractura. No obstante, estos incrementos son en general modestos en relación con la pérdida acumulada durante años de evolución silente, y los cambios en la microestructura ósea suelen ser en gran medida irreversibles. Además, algunas complicaciones, como las fracturas vertebrales, pueden ocasionar deformidades cifóticas permanentes, pérdida de estatura y dolor crónico, con impacto funcional y calidad de vida comprometidos. Por ello, en medicina ósea, la prevención tiene un valor incuestionable.
Las medidas preventivas abarcan tanto intervenciones no farmacológicas como farmacológicas. Entre las no farmacológicas se incluye una adecuada ingesta de calcio (al menos 1000 miligramos diarios en adultos y 1200 miligramos diarios en mujeres posmenopáusicas y hombres mayores de 70 años) y una suplementación apropiada de vitamina D, dado que su síntesis cutánea es insuficiente en muchas poblaciones por exposición solar limitada. El objetivo es mantener niveles séricos de 25-hidroxivitamina D por encima de 30 nanogramos por mililitro en personas en riesgo. La actividad física regular, especialmente ejercicios de resistencia y carga axial, es crucial para mantener la masa ósea y mejorar la fuerza muscular, lo cual reduce el riesgo de caídas, un factor precipitante fundamental de fracturas en personas mayores.
Desde el punto de vista farmacológico, el uso preventivo de agentes como los bisfosfonatos, el raloxifeno o incluso las terapias hormonales en personas seleccionadas —por ejemplo, mujeres jóvenes con hipogonadismo o pacientes que inician tratamiento con glucocorticoides— puede preservar la densidad ósea y evitar la progresión hacia osteoporosis clínica. En pacientes de alto riesgo, el tratamiento precoz basado en criterios de densidad mineral ósea o en herramientas predictivas como la puntuación FRAX puede prevenir no solo la pérdida ósea sino también eventos clínicos mayores como fracturas vertebrales o de cadera.
Es importante destacar que la prevención de la osteoporosis tiene repercusiones que trascienden el ámbito óseo. Las fracturas osteoporóticas, particularmente las de cadera, se asocian a un incremento de la morbimortalidad, institucionalización prolongada, pérdida de autonomía y altos costos sanitarios. Por lo tanto, la intervención temprana sobre los factores de riesgo modificables y la implementación de estrategias de detección oportuna permiten no solo mejorar la salud ósea, sino también preservar la funcionalidad y calidad de vida en la población envejecida.

Fuente y lecturas recomendadas:
- Bird ST et al. Severe hypocalcemia with denosumab among older female-dialysis-dependent patients. JAMA. 2024;331:491. [PMID: 38241060]
- Gregson CL et al. UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos. 2022;17:58. [PMID: 35378630]
- Händel MN et al. Fracture risk reduction and safety by osteoporosis treatment compared with placebo or active comparator in postmenopausal women: systematic review, network metaanalysis, and meta-regression analysis of randomised clinical trials. BMJ. 2023;381:e068033. [PMID: 37130601]
- Walker MD et al. Postmenopausal osteoporosis. N Engl J Med. 2023;389:1979. [PMID: 37991856]
Originally posted on 2 de mayo de 2025 @ 4:19 PM